题目内容
10.标准状况下,0.56L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.14g(假设C2H4完全被吸收),则乙烯占混合气体体积的( )| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
分析 甲烷和溴不反应,乙烯和溴发生加成反应生成1,2-二溴乙烷,所以将混合气体通入足量溴水中时,溴水增加质量为乙烯质量=0.14g,则n(C2H4)=$\frac{0.14g}{28g/mol}$=0.005mol,根据V=nVm计算乙烯体积,从而计算乙烯体积分数.
解答 解:甲烷和溴不反应,乙烯和溴发生加成反应生成1,2-二溴乙烷,所以将混合气体通入足量溴水中时,溴水增加质量为乙烯质量=0.14g,则n(C2H4)=$\frac{0.14g}{28g/mol}$=0.005mol,乙烯体积V=nVm=0.005L×22.4L/mol=0.112L,则乙烯只有体积分数=$\frac{0.112L}{0.56L}×100%$=20%,故选A.
点评 本题考查混合物的有关计算,侧重考查学生分析计算能力,明确物质的量公式中各个物理量的关系及乙烯性质特点即可解答,题目难度不大.

练习册系列答案
相关题目
20.只用一种试剂就能区别FeCl3和FeCl2二种溶液,该试剂可用( )
①硫氰化钾溶液 ②NaOH溶液 ③氯水 ④铁粉.
①硫氰化钾溶液 ②NaOH溶液 ③氯水 ④铁粉.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
1.鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.实验测得角鲨烯分子是链状结构,分子中含有30个碳原子且碳、氢元素质量比为7.2:1,下列说法中不正确的是( )
| A. | 角鲨烯分子式为C30H50 | |
| B. | 角鲨烯与分子式为C29H48的物质可能属于同系物 | |
| C. | 角鲨烯完全加氢后为C30H62 | |
| D. | 1mol角鲨烯最多可与5mol溴单质加成 |
5.下列物质中富含维生素C的是( )
| A. | 鱼 | B. | 大米 | C. | 葡萄 | D. | 植物油 |
15.下列关于常见有机化合物的说法中,不正确的是( )
| A. | 葡萄糖是人体内主要供能物质,血液中葡萄糖含量过低,会使人患“低血糖”症 | |
| B. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键 | |
| C. | 分子式为C5H12的有机物只有三种,它们互为同系物 | |
| D. | 乙酸乙酯的水解反应;苯和硝酸反应生成硝基苯,两者的反应类型相同 |
2. (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4>H3PO4; HClO4>HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
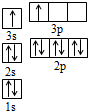
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.
 (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4>H3PO4; HClO4>HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.