题目内容
19.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)Na>Al>C>O>H
(2)X与Y能形成多种化合物,其中六原子既含极性键又含非极性键的物质有(写分子式)C2H4
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A$?_{D}^{C}$B(在水溶液中进行)其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式O=C=O;D的电子式
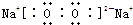
①如果A、B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2AlO2-+3H2O+CO2=2Al(OH)3+CO32-
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.则鉴别两种溶液的方法是分取两试管,取少量溶液,分别加入BaCl2溶液,有白色沉淀生成的是NaHCO3或分别加热有气泡放出的是NaHCO3或分别滴加盐酸马上有气泡生成的是NaHCO3.
分析 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z是O元素、R为Al元素,X、Y两元素最高正价与最低负价之和均为0,X的原子序数小于Y,且Y元素原子序数小于Z,所以X是H元素、Y是C元素;Q与X同主族,且Q的原子序数大于O元素,所以Q是Na元素,再结合原子结构、元素周期律来分析解答.
解答 解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z是O元素、R为Al元素,X、Y两元素最高正价与最低负价之和均为0,X的原子序数小于Y,且Y元素原子序数小于Z,所以X是H元素、Y是C元素;
Q与X同主族,且Q的原子序数大于O元素,所以Q是Na元素;
(1)原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以这几种元素原子半径大小顺序是:Na>Al>C>O>H,
故答案为:Na>Al>C>O>H;
(2)X与Y能形成多种化合物其中既含极性键又含非极性键,其中六原子既含极性键又含非极性键的物质为:C2H4,
故答案为:C2H4;
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A$?_{D}^{C}$B(要在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体,则D是Na2O2,C是CO2,则C的结构式为O=C=O,D的电子式为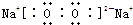 ,
,
故答案为:O=C=O;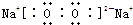 ;
;
①如果A、B均由三种元素组成,B为两性不溶物,则B是Al(OH)3,D是过氧化钠、C是二氧化碳,则A是偏铝酸钠,其化学式为NaAlO2,偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸根离子或碳酸氢根离子,离子反应方程式为:AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2AlO2-+3H2O+CO2=2 Al(OH)3+CO32-,
故答案为:AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2AlO2-+3H2O+CO2=2 Al(OH)3+CO32-;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,B和氢氧化钠反应生成A,A和二氧化碳反应生成B,所以B是碳酸氢钠、A是碳酸钠,鉴别二者的方法为:分取两试管,取少量溶液,分别加入BaCl2溶液,有白色沉淀生成的是NaHCO3或分别加热有气泡放出的是NaHCO3或分别滴加盐酸马上有气泡生成的是NaHCO3,
故答案为:分取两试管,取少量溶液,分别加入BaCl2溶液,有白色沉淀生成的是NaHCO3或分别加热有气泡放出的是NaHCO3或分别滴加盐酸马上有气泡生成的是NaHCO3.
点评 本题考查了位置结构性质的相互关系及应用,题目难度中等,正确推断元素是解本题关键,根据元素在周期表中的位置及原子结构确定元素,再结合物质的性质来分析解答.

 教学练新同步练习系列答案
教学练新同步练习系列答案| 容器编号 | 起始各物质的物质的量(mol) | 达到平衡时能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出23.15kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出QkJ能量 |
| A. | 容器①、②中反应的化学平衡常数相等 | |
| B. | 平衡时,两容器中氨的体积分数均约为14.3% | |
| C. | 反应②达到平衡时,放出的热量Q=23.15 kJ | |
| D. | 若①的体积为5.0 L,则达到平衡时放出的热量小于23.15 kJ |
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
| A. | 甲醛 | B. | 甲醇 | C. | 丁烷 | D. | 丙烯 |
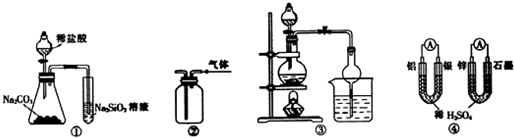
| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置通过排空气法收集C2H4气体 | |
| C. | 图③所示装置可用于制取乙酸乙酯,分液漏斗中装的是乙醇 | |
| D. | 图④两个装置红中能够通过导线的电子数相同时,生成的H2的物质的量也相同 |
| A. | 因发生“钝化”而不反应 | B. | 产生的SO2为0.100 mol | ||
| C. | 产生的SO2少于0.100 mol | D. | 除SO2外还会有H2产生 |