题目内容
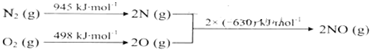
16.同周期元素X、Y可组成化学式为XY2的共价化合物,则X、Y的原子序数可能是( )| A. | 11和16 | B. | 6和8 | C. | 12和17 | D. | 7和8 |
分析 XY2型共价化合物中X化合价如为+4价,则Y为-2价,如X为+2价,则Y为-1价,以此解答该题.
解答 解:XY2型共价化合物中X化合价如为+4价,可能为C、N等元素,则Y为-2价,与X为同周期,应为O,原子序数分别为6、8和7、8,分别是CO2和NO2,如X为+2价,则Y为-1价,同周期元素没有符合的,
故选BD.
点评 本题考查元素周期表由元素周期律的综合应用,题目难度中等,试题侧重于学生的分析能力的考查,为高考常见题型,熟悉常见元素的位置,利用列举法进行解答.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. |  的消去产物有两种 的消去产物有两种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别乙醛、四氯化碳、苯和乙酸 |
7.下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答:
(1)表中元素,只有负价而无正价的是F,还原性最强的单质是Na
(2)A元素与 I元素形成的化合物的化学式是H2O、H2O2,它们都是共价化合物 (填“共价化合物”或“离子化合物”).
(3)在B、C、F中,原子半径最小的是P;
(4)D、E两元素的最高价氧化物的水化物中,酸性较强的是HNO3;
(5)E为气态氢化物为NH3,实验室制取它的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(6)用电子式表示B和H组成化合物的形成过程 .
.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | I | G | ||||
| 3 | B | C | F | H |
(2)A元素与 I元素形成的化合物的化学式是H2O、H2O2,它们都是共价化合物 (填“共价化合物”或“离子化合物”).
(3)在B、C、F中,原子半径最小的是P;
(4)D、E两元素的最高价氧化物的水化物中,酸性较强的是HNO3;
(5)E为气态氢化物为NH3,实验室制取它的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(6)用电子式表示B和H组成化合物的形成过程
 .
.
4.有关化学键的说法正确的是( )
| A. | 化学键包括共价键、离子键、金属键、氢键 | |
| B. | 单键都是σ键 | |
| C. | 化学键都有方向性和饱和性 | |
| D. | 极性共价键都是σ键 |
11.“轻轨电车”是近年来又一新兴的交通工具,具有无污染的优点.轻轨电车运行中,在轻轨电车跟架空电线的接触点上,由于高速摩擦会产生高温,因此接触点的材料应具有耐高温、不易氧化、能导电的性质.你认为最合适选作接触点的是( )
| A. | 金刚石 | B. | 石墨 | C. | 铝 | D. | 铜 |
5.下列电离方程式的书写正确的是( )
| A. | Al2(SO4)3=2Al3++3SO42- | B. | HF=H++F- | ||
| C. | H3PO4?3H++PO43- | D. | NaHCO3=Na++H++CO32- |
6.下列有关物质分类正确的是( )
| A. | 分散系:盐酸、硫酸铜、空气 | B. | 电解质:烧碱、硫酸、盐酸 | ||
| C. | 盐:氯化钠、硫酸铝、碳酸钙 | D. | 非电解质:石墨、CO2、蔗糖 |
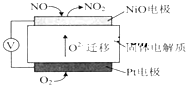 NOx是汽车尾气中的主要污染物之一.
NOx是汽车尾气中的主要污染物之一.