题目内容
7.下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答:| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | I | G | ||||
| 3 | B | C | F | H |
(2)A元素与 I元素形成的化合物的化学式是H2O、H2O2,它们都是共价化合物 (填“共价化合物”或“离子化合物”).
(3)在B、C、F中,原子半径最小的是P;
(4)D、E两元素的最高价氧化物的水化物中,酸性较强的是HNO3;
(5)E为气态氢化物为NH3,实验室制取它的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(6)用电子式表示B和H组成化合物的形成过程
 .
.
分析 由元素在周期表中位置可知,A为H元素、B为Na、C为Al、D为C元素、E为N元素、F为P元素、G为F元素、H为Cl、I为O元素,
(1)氟元素没有最高正化合价;金属性越强,单质还原性越强;
(2)H元素与 O元素形成的化合物有H2O、H2O2;
(3)同周期元素从左到右原子半径逐渐减小;
(4)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
(5)实验室用氯化铵和氢氧化钙在加热条件下制备氨气;
(6)B和H组成化合物为NaCl,为离子化合物.
解答 解:由元素在周期表中位置可知,A为H元素、B为Na、C为Al、D为C元素、E为N元素、F为P元素、G为F元素、H为Cl、I为O元素.
(1)氟元素没有最高正化合价,上述元素中,Na的金属性最强,故Na单质还原性最强,
故答案为:F;Na;
(2)H元素与 O元素形成的化合物有H2O、H2O2,都是共价化合物,故答案为:H2O;H2O2;共价化合物;
(3)同周期元素从左到右原子半径逐渐减小,在Na、Al、P中,原子半径最小的是P,故答案为:P;
(4)非金属性N>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性较强的是HNO3,故答案为:HNO3;
(5)E为气态氢化物为NH3,实验室用氯化铵和氢氧化钙在加热条件下制备氨气,方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:NH3;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(6)B和H组成化合物为NaCl,NaCl为离子化合物,用电子式表示形成过程为 ,
,
故答案为: .
.
点评 本题考查元素的位置、结构和性质的推断,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意元素周期律的递变规律等知识的积累.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 1.0L1.0mol•L-1的NaClO水溶液中含有的氧原子数为NA | |
| B. | 总质量为ag的CO和N2的混合物中所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| C. | 2.24L 的2H35Cl分子中的中子数是1.9NA | |
| D. | 某密闭容器中盛有0.1mol N2和0.3molH2,在一定条件下充分反应,形成N-H键的数目为0.6NA |
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
| A. | 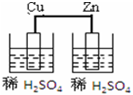 | B. | 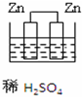 | C. | 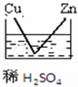 | D. |  |
①乙苯 ②1,3-丁二烯 ③己烷 ④溴乙烷 ⑤乙酸 ⑥苯酚.
| A. | 只有① | B. | 只有①、③、④、⑤ | C. | 只有③、④、⑥ | D. | 只有①、③ |
| A. | 11和16 | B. | 6和8 | C. | 12和17 | D. | 7和8 |
 .
.