题目内容
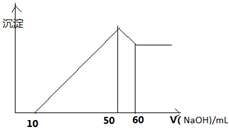 某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )
某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )| A、1:1:1:1 |
| B、2:2:1:1 |
| C、2:1:1:1 |
| D、4:4:1:1 |
考点:离子方程式的有关计算
专题:计算题
分析:根据图象知,横坐标为0-10mL时发生的反应是:H++OH-=H2O,加入10mLNaOH溶液结合中和氢离子,n(H+)=n(NaOH);
横坐标为10-50mL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Cu2++2OH-=Cu(OH)2↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据OH-守恒,2n[Mg(OH)2]+3n[Al(OH)3]+2n[Cu(OH)2]+=n(NaOH),结合元素守恒n(Mg2+)=n[Mg(OH)2]、n(Cu2+)=n[Cu(OH)2];
横坐标为50-60mL时,发生的化学反应是:Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3完全溶解消耗消耗10mL NaOH溶液,根据消耗的氢氧化钠计算n[Al(OH)3],再根据铝元素守恒可知,n(Al3+)=n[Al(OH)3],据此计算解答.
横坐标为10-50mL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Cu2++2OH-=Cu(OH)2↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据OH-守恒,2n[Mg(OH)2]+3n[Al(OH)3]+2n[Cu(OH)2]+=n(NaOH),结合元素守恒n(Mg2+)=n[Mg(OH)2]、n(Cu2+)=n[Cu(OH)2];
横坐标为50-60mL时,发生的化学反应是:Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3完全溶解消耗消耗10mL NaOH溶液,根据消耗的氢氧化钠计算n[Al(OH)3],再根据铝元素守恒可知,n(Al3+)=n[Al(OH)3],据此计算解答.
解答:
解:根据图象知,横坐标为0-10mL时发生的反应是:H++OH-=H2O,加入10mLNaOH溶液结合中和氢离子,n(H+)=n(NaOH)=0.01L×0.1mol/L=0.001mol;
横坐标为50-60mL时,发生的化学反应是:Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3完全溶解消耗消耗10mLNaOH溶液,由方程式可知n[Al(OH)3]=n(NaOH)=0.01L×0.1mol/L=0.001mol,根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=0.001mol;
横坐标为10-50mL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Cu2++2OH-=Cu(OH)2↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据OH-守恒,2n[Mg(OH)2]+3n[Al(OH)3]+2n[Cu(OH)2]+=n(NaOH),Mg2+ Cu2+物质的量之为1:1,故4n[Mg(OH)2]+0.003mol=0.04L×0.1mol/L,故n[Mg(OH)2]=0.0025mol,n[Cu(OH)2]=0.0025mol,
则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为0.001:0.001:0.0025:0.0025=4:4:1:1,
故选D.
横坐标为50-60mL时,发生的化学反应是:Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3完全溶解消耗消耗10mLNaOH溶液,由方程式可知n[Al(OH)3]=n(NaOH)=0.01L×0.1mol/L=0.001mol,根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=0.001mol;
横坐标为10-50mL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Cu2++2OH-=Cu(OH)2↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据OH-守恒,2n[Mg(OH)2]+3n[Al(OH)3]+2n[Cu(OH)2]+=n(NaOH),Mg2+ Cu2+物质的量之为1:1,故4n[Mg(OH)2]+0.003mol=0.04L×0.1mol/L,故n[Mg(OH)2]=0.0025mol,n[Cu(OH)2]=0.0025mol,
则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为0.001:0.001:0.0025:0.0025=4:4:1:1,
故选D.
点评:本题考查反应图象有关计算,能根据图象正确判断各阶段发生的化学反应是解本题的关键,难度中等,注意利用守恒的计算.

练习册系列答案
相关题目
当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A、矿泉水 |
| B、稀HCl |
| C、FeCl3溶液 |
| D、Fe(OH)3胶体 |
根据下列实验不能证明一元酸HR为弱酸的是( )
| A、室温时,NaR溶液的pH大于7 |
| B、同等浓度等体积盐酸分别与Zn反应产生H2量相同 |
| C、HR溶液加入少量NaR固体,溶解后溶液的pH变大 |
| D、室温时,0.01mol?L-1的HR溶液pH=4 |
下列关于卤素单质的叙述,不正确的是( )
| A、单质的颜色随核电荷数的增加逐渐变深 |
| B、随核电荷数的增加单质的氧化性逐渐增强 |
| C、随核电荷数的增加气态氢化物的稳定性逐渐减弱 |
| D、单质的熔沸点随核电荷数的增加逐渐升高 |
下列因果关系成立的是( )
| A、因为NH3的水溶液可以导电,所以NH3是电解质 |
| B、因为Al能与强碱溶液反应,所以Al有一定的非金属性 |
| C、因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH |
| D、因为SO2可以使溴水褪色,所以SO2具有漂白性 |
用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
| A、2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA | ||
B、1mol Na2CO3晶体中含CO
| ||
| C、常温常压下,92g的NO2和N2O4混合气体中含有原子数为6NA | ||
| D、惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2L |
在下列溶液中,各组离子一定能够大量共存的是( )
| A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、K+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-? |
| C、pH=12的溶液:K+、Mg2+、Cl-、Br- |
| D、碳酸氢钠溶液:K+、SO32-、Cl-、H+ |
下列有关说法不正确的是( )
| A、太阳能电池使用的材料主要是硅 |
| B、实验室可以用NaOH溶液处理SO2和NO2废气 |
| C、氯气具有很强的氧化性,在化学反应中只能作氧化剂 |
| D、用盐酸可以清洗长期存放过FeCl3溶液的试剂瓶 |