题目内容
用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
| A、2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA | ||
B、1mol Na2CO3晶体中含CO
| ||
| C、常温常压下,92g的NO2和N2O4混合气体中含有原子数为6NA | ||
| D、惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量,钠是活泼金属,与过量氧气完全反应,电子转移依据反应的钠计算;
B、碳酸钠晶体是由钠离子和碳酸根离子构成计算分析;
C、NO2和N2O4混合气体最简式相同为NO2,计算92gNO2中所含原子数分析;
D、依据电解原理和电极反应,结合电子守恒计算生成气体分析判断.
| m |
| M |
B、碳酸钠晶体是由钠离子和碳酸根离子构成计算分析;
C、NO2和N2O4混合气体最简式相同为NO2,计算92gNO2中所含原子数分析;
D、依据电解原理和电极反应,结合电子守恒计算生成气体分析判断.
解答:
解:A、2.3g金属钠物质的量=
=0.1mol,与过量的氧气反应,无论加热与否转移电子数均为0.1NA,故A正确;
B、碳酸钠由钠离子和碳酸根离子构成,1mol Na2CO3晶体中含CO32-数目一定为NA,故B正确;
C、NO2和N2O4混合气体最简式相同为NO2,计算92gNO2中所含原子数=
×3×NA=6NA ,故C正确;
D、惰性电极电解食盐水,阳极电极反应为2Cl--2e-=Cl2↑,若电路中通过NA个电子物质的量为1mol,则阳极产生气体0.5mol,不一定是标准状况,气体体积不一定是11.2L,故D错误;
故选D.
| 2.3g |
| 23g/mol |
B、碳酸钠由钠离子和碳酸根离子构成,1mol Na2CO3晶体中含CO32-数目一定为NA,故B正确;
C、NO2和N2O4混合气体最简式相同为NO2,计算92gNO2中所含原子数=
| 92g |
| 46g/mol |
D、惰性电极电解食盐水,阳极电极反应为2Cl--2e-=Cl2↑,若电路中通过NA个电子物质的量为1mol,则阳极产生气体0.5mol,不一定是标准状况,气体体积不一定是11.2L,故D错误;
故选D.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移,电解原理分析判断,注意气体摩尔体积的条件分析应用,掌握基础是关键,难度中等.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
| A、最终生成白色沉淀 |
| B、最终生成红褐色沉淀 |
| C、有气泡产生 |
| D、无变化 |
下列事实不能说明一元酸HA为弱酸的是( )
| A、常温下0.1mol?L-1的HA溶液pH为5 |
| B、常温下NaA溶液的pH>7 |
| C、HA溶液中存在H+、OH-、A-、HA |
| D、HA溶液能与大理石反应 |
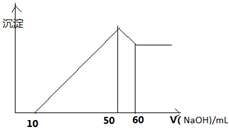 某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )
某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )| A、1:1:1:1 |
| B、2:2:1:1 |
| C、2:1:1:1 |
| D、4:4:1:1 |
下列关于钠说法中错误的是( )
| A、金属钠在空气中燃烧,生成氧化钠 |
| B、钠是密度比水小的金属单质,能浮在水面上 |
| C、钠是银白色、质软、熔点相对较低 |
| D、将金属钠放在石棉网上用酒精灯加热后,金属钠剧烈燃烧,产生黄色火焰. |
pH相等的氨水和氢氧化钠溶液,分别用蒸馏水稀释相同倍数后,两溶液pH的关系是( )
| A、前者大 | B、后者大 |
| C、相等 | D、无法比较 |
以下化学反应属于复分解反应的是( )
| A、CaO+H20═Ca(OH)2 | ||||
B、Fe2O3+3CO
| ||||
| C、Cl2+2KBr═2KCl+Br2 | ||||
| D、Na2CO3+BaCl2═2NaCl+BaCO3↓ |
下列各对化合物中,化学键与晶体类型都相同的一组是( )
| A、H2S、HCl |
| B、NaCl、HF |
| C、SiO2、CO2 |
| D、CCl4、KCl |