题目内容
下列说法不正确的是( )
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
⑤将SO2通入溴水中,证明SO2具有漂白性
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色逐渐褪去,证明Na2CO3溶液中存在水解平衡
⑦因为CO2的相对分子质量比SiO2的小,所以CO2的熔沸点比SiO2的熔沸点低
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,不能证明原溶液中一定含CO32- 离子.
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
⑤将SO2通入溴水中,证明SO2具有漂白性
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色逐渐褪去,证明Na2CO3溶液中存在水解平衡
⑦因为CO2的相对分子质量比SiO2的小,所以CO2的熔沸点比SiO2的熔沸点低
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,不能证明原溶液中一定含CO32- 离子.
| A、②④⑥⑦ | B、①②③⑥ |
| C、①③④⑤⑦ | D、③④⑤⑦⑧ |
考点:物质的检验和鉴别的基本方法选择及应用,二氧化硫的化学性质,硅和二氧化硅,钠的重要化合物
专题:物质检验鉴别题,元素及其化合物
分析:①CO2与BaCl2不反应,但通入溶有足量氨气的BaCl2溶液中会生成大量的碳酸根离子,可生成沉淀;
②在酸性条件下Fe2+与NO3-发生氧化还原反应生成Fe3+;
③根据硫酸根离子的检验方法,应先加盐酸,排除其它离子的干扰;
④另一块用铝箔包住,Al与NaOH溶液反应也能生成氢气,所以该块产生的氢气多;
⑤将SO2通入溴水中,发生氧化还原反应;
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后,碳酸根离子与钡离子反应,水解平衡逆向移动;
⑦CO2为分子晶体,SiO2为原子晶体;
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,气体为二氧化碳,原溶液中可能含HCO3-、CO32- 离子.
②在酸性条件下Fe2+与NO3-发生氧化还原反应生成Fe3+;
③根据硫酸根离子的检验方法,应先加盐酸,排除其它离子的干扰;
④另一块用铝箔包住,Al与NaOH溶液反应也能生成氢气,所以该块产生的氢气多;
⑤将SO2通入溴水中,发生氧化还原反应;
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后,碳酸根离子与钡离子反应,水解平衡逆向移动;
⑦CO2为分子晶体,SiO2为原子晶体;
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,气体为二氧化碳,原溶液中可能含HCO3-、CO32- 离子.
解答:
解:①由于碳酸的酸性比盐酸弱,则CO2与BaCl2不反应,但通入通入溶有足量氨气的BaCl2溶液中,溶液中生成大量的碳酸根离子,碳酸根离子和钡离子结合生成碳酸钡沉淀,故①错误;
②在酸性条件下Fe2+与NO3-发生氧化还原反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成Fe3+,加入KSCN溶液Fe3++3SCN-?Fe(SCN)3生成红褐色Fe(SCN)3,溶液呈红褐色,故②正确;
③滴入盐酸酸化的BaCl2溶液,产生不溶于盐酸的白色沉淀,不能排除生成AgCl沉淀的可能性,检验硫酸根离子应先加入盐酸,如无沉淀,再加入氯化钡,观察是否有沉淀生成,故③错误;
④另一块用铝箔包住,Al与NaOH溶液反应生成氢气,则将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,其中另一块用铝箔包住,铝箔中的Al与钠反应的产物NaOH溶液反应也能生成氢气,该块产生的氢气多,所以两者放出的氢气质量不相等,故④错误;
⑤将SO2通入溴水中,发生氧化还原反应,体现二氧化硫的还原性,与漂白性无关,故⑤错误;
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后,碳酸根离子与钡离子反应,水解平衡逆向移动,氢氧根离子浓度减小,则颜色变浅,故⑥正确;
⑦CO2为分子晶体,SiO2为原子晶体,则CO2的熔沸点比SiO2的熔沸点低,与相对分子质量无关,故⑦错误;
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,气体为二氧化碳,原溶液中可能含HCO3-、CO32- 离子,或二者均存在,故⑧正确;
故选C.
②在酸性条件下Fe2+与NO3-发生氧化还原反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成Fe3+,加入KSCN溶液Fe3++3SCN-?Fe(SCN)3生成红褐色Fe(SCN)3,溶液呈红褐色,故②正确;
③滴入盐酸酸化的BaCl2溶液,产生不溶于盐酸的白色沉淀,不能排除生成AgCl沉淀的可能性,检验硫酸根离子应先加入盐酸,如无沉淀,再加入氯化钡,观察是否有沉淀生成,故③错误;
④另一块用铝箔包住,Al与NaOH溶液反应生成氢气,则将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,其中另一块用铝箔包住,铝箔中的Al与钠反应的产物NaOH溶液反应也能生成氢气,该块产生的氢气多,所以两者放出的氢气质量不相等,故④错误;
⑤将SO2通入溴水中,发生氧化还原反应,体现二氧化硫的还原性,与漂白性无关,故⑤错误;
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后,碳酸根离子与钡离子反应,水解平衡逆向移动,氢氧根离子浓度减小,则颜色变浅,故⑥正确;
⑦CO2为分子晶体,SiO2为原子晶体,则CO2的熔沸点比SiO2的熔沸点低,与相对分子质量无关,故⑦错误;
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,气体为二氧化碳,原溶液中可能含HCO3-、CO32- 离子,或二者均存在,故⑧正确;
故选C.
点评:本题考查物质的检验和鉴别,为高频考点,涉及离子的检验、元素化合物、氧化还原反应等有关知识,注意把握相关物质的性质、常见物质的检验和鉴别即可解答,平时注重知识的积累,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现有一块金属钠露置于空气中一段时间,为检验该固体是否部分变质为碳酸钠,先将固体样品溶解于水得到溶液,并采取下列措施,其中可以实现实验目的是( )
| A、测所得溶液的pH |
| B、取溶液少量,向其中滴入酚酞观察溶液是否变红 |
| C、取溶液少量,向其中加入盐酸观察是否有气泡产生 |
| D、取溶液少量,向其中加入CuSO4溶液,观察是否有沉淀产生 |
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、22.4L O3中含3nA个氧原子 |
| B、标准状况下,22.4L CH2Cl2含有2nA氯原子 |
| C、1mol SO2与足量的H2S充分反应,转移2nA个电子 |
| D、17g H2O2中含有9nA个质子 |
如表代表周期表中的几种短周期元素,下列说法中正确的是( )
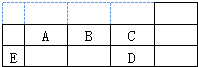

| A、C、D的氢化物沸点D比C高 |
| B、第一电离能A、B、C依此增大 |
| C、A、B、C中电负性最大的A |
| D、五种元素中,最高价氧化物对应的水化物酸性最强的是D |
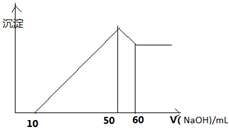 某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )
某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )| A、1:1:1:1 |
| B、2:2:1:1 |
| C、2:1:1:1 |
| D、4:4:1:1 |
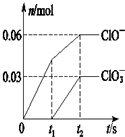 将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A、烧碱溶液中NaOH的质量是3.6g |
| B、反应中转移电子的物质的量是0.09mol |
| C、氧化性ClO-<ClO3- |
| D、ClO3-的生成是由于温度升高引起的 |
pH相等的氨水和氢氧化钠溶液,分别用蒸馏水稀释相同倍数后,两溶液pH的关系是( )
| A、前者大 | B、后者大 |
| C、相等 | D、无法比较 |
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、非标准状况下,1mol任何气体的体积不可能为22.4L |
| B、常温常压下,0.2mol Na2O2与足量H2O反应,转移电子的数目为0.2NA |
| C、标准状况下,NA个水分子所占的体积为22.4L |
| D、常温常压下,0.2mol Na2O2含有0.4mol阴离子 |