题目内容
根据下列实验不能证明一元酸HR为弱酸的是( )
| A、室温时,NaR溶液的pH大于7 |
| B、同等浓度等体积盐酸分别与Zn反应产生H2量相同 |
| C、HR溶液加入少量NaR固体,溶解后溶液的pH变大 |
| D、室温时,0.01mol?L-1的HR溶液pH=4 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:不能证明一元酸HR为弱酸,说明该实验不能证明HR部分电离,据此分析解答.
解答:
解:A.室温下,NaR溶液的pH大于7,说明NaR为强碱弱酸盐,所以能证明HR为弱酸,故A不选;
B.同等浓度等体积盐酸分别与Zn反应产生H2量相同,说明HR是一元酸,但不能说明HR部分电离,所以不能说明HR是弱酸,故B选;
C.HR溶液加入少量NaR固体,溶解后溶液的pH变大,说明HR溶液中存在电离平衡,则HR为弱酸,故C不选;
D.室温时,0.01mol?L-1的HR溶液pH=4,酸浓度大于氢离子浓度,说明HR部分电离,则证明HR是弱酸,故D不选;
故选B.
B.同等浓度等体积盐酸分别与Zn反应产生H2量相同,说明HR是一元酸,但不能说明HR部分电离,所以不能说明HR是弱酸,故B选;
C.HR溶液加入少量NaR固体,溶解后溶液的pH变大,说明HR溶液中存在电离平衡,则HR为弱酸,故C不选;
D.室温时,0.01mol?L-1的HR溶液pH=4,酸浓度大于氢离子浓度,说明HR部分电离,则证明HR是弱酸,故D不选;
故选B.
点评:本题考查了弱电解质的电离,根据电离程度确定电解质强弱,不能根据物质的溶解性确定电解质强弱,为易错点.

练习册系列答案
相关题目
下列说法正确的是( )
| A、若以w1和w2分别表示浓度为a mol?L-1和b mol?L-1氨水的质量分数,且知2a=b,则w2>2w1(氨水的密度比纯水的小) |
| B、7.8g Na2O2与CO2完全反应,转移0.2mol电子 |
| C、CO2、SO3、NO2和水反应均能生成酸,都属于酸性氧化物 |
| D、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
| A、最终生成白色沉淀 |
| B、最终生成红褐色沉淀 |
| C、有气泡产生 |
| D、无变化 |
在稀CH3COOH溶液中存在如下电离平衡:CH3COOH═CH3COO-+H+,下列叙述正确的是( )
| A、加入水时,平衡左移 |
| B、加入少量0.1mol/L HCl溶液,溶液中c(H+)减小 |
| C、加入少量NaOH固体,平衡右移 |
| D、加入少量CH3COONa固体,平衡右移 |
下列关于硅的说法不正确的是( )
| A、硅是非金属元素,它的单质是灰黑色有金属光泽的固体 |
| B、硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 |
| C、加热到一定温度时,硅能与氢气、氧气等非金属反应 |
| D、硅的化学性质不活泼,常温下不与任何物质起反应 |
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、22.4L O3中含3nA个氧原子 |
| B、标准状况下,22.4L CH2Cl2含有2nA氯原子 |
| C、1mol SO2与足量的H2S充分反应,转移2nA个电子 |
| D、17g H2O2中含有9nA个质子 |
下列事实不能说明一元酸HA为弱酸的是( )
| A、常温下0.1mol?L-1的HA溶液pH为5 |
| B、常温下NaA溶液的pH>7 |
| C、HA溶液中存在H+、OH-、A-、HA |
| D、HA溶液能与大理石反应 |
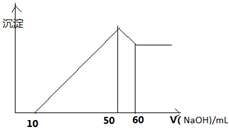 某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )
某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )| A、1:1:1:1 |
| B、2:2:1:1 |
| C、2:1:1:1 |
| D、4:4:1:1 |
下列各对化合物中,化学键与晶体类型都相同的一组是( )
| A、H2S、HCl |
| B、NaCl、HF |
| C、SiO2、CO2 |
| D、CCl4、KCl |