题目内容
【题目】NH3是重要的化工原料,经一系列反应可得到HNO3、CO(NH2)2、HCN等产品。
(1)以氨气为原料合成HNO3工艺如下,写出N2O4转化为HNO3的反应方程式_____。
![]()
(2)以NH3和CO2为原料生产尿素的反应如下:
反应Ⅰ:2NH3(l) + CO2(g) ![]() NH2COONH4(l) Δ H1 = a kJ·mol-1
NH2COONH4(l) Δ H1 = a kJ·mol-1
反应Ⅱ:NH2COONH4(l) ![]() NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
① 已知NH3(l) ![]() NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)
NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g) ![]() NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是_____。
NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是_____。
② 一定条件下,往恒容密闭容器中投入4 mol NH3和 1 mol CO2,测得各组分物质的量随时间变化如图1。下列说法正确的是_____。
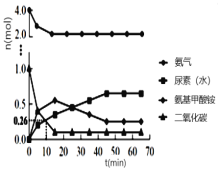
A.选择合适的碳氮比有利于提高产率
B.反应Ⅰ的活化能比反应Ⅱ小
C.过量氨气可以与反应生成的水结合,有利于尿素合成
D.气体物质的量不再变化时,反应达到平衡状态
(3)工业上利用氨气生产氢氰酸的反应为CH4(g) + NH3(g) ![]() HCN(g) + 3H2(g) Δ H>0
HCN(g) + 3H2(g) Δ H>0
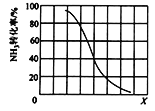
① 其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是_____(填“温度”或“压强”)。
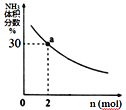
② 其它条件一定时,向2 L密闭容器中加入n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。平衡常数K=_____(请写出计算过程)
【答案】2N2O4+2H2O+O2=4HNO3 a+b-2c 反应为放热反应 ABC 压强 0.1875
【解析】
(1)由图可知,N2O4与O2、H2O反应生成HNO3,反应为2N2O4+O2+2H2O=4HNO3;
(2)①由Ⅰ:2NH3(l)+CO2(g)NH2COONH4(l) △H1=akJmol﹣l
Ⅱ:NH2COONH4(l)NH2CONH2(l)+H2O △H2=bkJmol﹣l
Ⅲ:NH3(l)NH3(g) △H3=ckJmol﹣1
结合盖斯定律可知,Ⅰ+Ⅱ﹣Ⅲ×2得到反应2NH3(g)+CO2(g)NH2CONH2(l)+H2O(l),则△H4=△H1+△H2-△H3×2=(a+b﹣2c)kJmol﹣l;该反应能自发进行,则△G=△H-T△S<0;该反应的熵减小,△S<0,为了满足△G<0,则△H<0,为放热反应;
②A.选择合适的碳氮比,增大平衡正向移动程度,有利于提高产率,A正确;
B.根据图像,反应开始时,快速生成氨基甲酸铵,而尿素的量较少,说明反应Ⅰ能够快速进行,而反应Ⅱ较慢;一般情况下,活化能大,反应速率慢,则Ⅰ的活化能比Ⅱ的活化能小,B正确;
C.过量氨气可以与反应生成的水结合,有利于反应Ⅱ的平衡正向移动,有利于尿素合成,C正确;
D.根据图像,可知当CO2的量不变的时候,反应Ⅱ还在进行,反应并没有达到平衡,D错误;
答案为ABC;
(3)①根据图像可知,随着X的增大,NH3的转化率降低。若增大压强,平衡逆向移动,NH3的转化率降低;若升高温度,平衡正向移动,NH3的转化率增大;X增大时,NH3转化率减小,可知X表示压强;
②由图可知,向2L密闭容器中加入2molCH4和2molNH3,根据三等式,设转化的CH4的浓度为xmol/L,有:
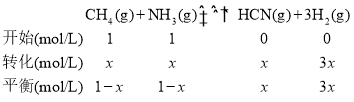
平衡时NH3体积分数为30%,则![]() =30%,解得x=
=30%,解得x=![]() mol/L,平衡常数K=
mol/L,平衡常数K=![]() 。
。

【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
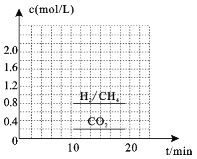
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
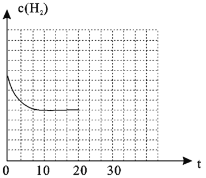
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g·cm-3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是______________,为使反应体系受热比较均匀,可________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________________________。
(3)写出苯甲醛与银氨溶液在一定的条件下发生反应的化学方程式:________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过___________、__________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是______________(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡