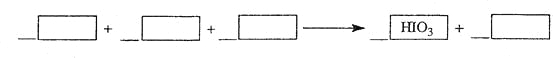
题目内容
【题目】常温下,不能证明乙酸是弱酸的实验事实是
A.0.1mol·L-1CH3COOH溶液pH>1
B.pH=1CH3COOH溶液稀释100倍,pH<3
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol·L-1CH3COONa溶液的pH大于7
【答案】C
【解析】
A.0.1mol/L的醋酸溶液pH>1,说明溶液中c(H+)<0.1mol/L,说明醋酸的电离不是完全的,那么醋酸即为弱酸,A项可证明;
B.对于强酸而言,由于其电离是完全的,所以在不考虑无限稀释的情况下,体积每增大十倍,根据公式![]() 可知,c(H+)减小十倍,pH增大1;现在对pH=1的醋酸进行稀释,体积扩大到100倍,但pH没有增加到3,说明醋酸不是强酸,B项可证明;
可知,c(H+)减小十倍,pH增大1;现在对pH=1的醋酸进行稀释,体积扩大到100倍,但pH没有增加到3,说明醋酸不是强酸,B项可证明;
C.醋酸可以与碳酸钠溶液反应生成CO2,说明醋酸的酸性强于碳酸,但无法证明醋酸是弱酸,C项不能证明;
D.醋酸钠溶液常温下,pH>7显碱性,是因为发生了醋酸根的水解反应,只有弱酸的酸根才会发生水解反应,所以醋酸是弱酸,D项可证明;
答案选C。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目