题目内容
【题目】一种磁性材料的磨削废料(含镍质量分数约为21%)的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍的工艺流程如下:
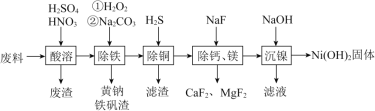
回答下列问题:
⑴合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应生成的气体只有N2。写出金属镍溶解的离子方程式:_______。
⑵“除铁”时H2O2的作用是__________,为了证明添加的H2O2已足量,应选择的试剂是__________(填“铁氰化钾”或“硫氰化钾”)溶液。
⑶“除铜”时,反应的离子方程式为__________,若用Na2S代替H2S除铜,优点是__________。
⑷已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是__________。
⑸镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M + Ni(OH)2![]() MH + NiOOH(式中M为储氢合金),写出电池放电过程中正极的电极反应式:__________。
MH + NiOOH(式中M为储氢合金),写出电池放电过程中正极的电极反应式:__________。
⑹已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组为测定黄钠铁矾的组成,进行了如下实验:
步骤Ⅰ.称取4.850g黄钠铁矾样品,加盐酸完全溶解后,配成100.00mL溶液A;
步骤Ⅱ.量取25.00mL溶液A,加入足量的KI,用0.2500 mol·L-1的Na2S2O3溶液进行滴定(反应为I2 + 2Na2S2O3 = 2NaI + Na2S4O6 ),滴定至终点时消耗30.00mL Na2S2O3溶液。
步骤Ⅲ![]() 另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
①用Na2S2O3溶液进行滴定时,使用的指示剂为__________,滴定达到终点时的颜色变化为__________。
②黄钠铁矾的化学式为 __________。
【答案】5Ni+12H++2NO3-= 5Ni2++N2↑+6H2O 将Fe2+氧化为Fe3+ 铁氰化钾 H2S+Cu2+=CuS↓+2H+ 无易挥发污染性气体H2S产生 过量的F-会生成氢氟酸腐蚀陶瓷容器 NiOOH + H2O + e-= Ni(OH)2 + OH- 淀粉溶液 当溶液蓝色恰好褪去,且半分钟内不再恢复 NaFe3(SO4)2(OH)6
【解析】
⑴已知Ni难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还边搅拌边缓慢加入了稀硝酸生成N2和Ni2+;
⑵H2O2具有氧化性,“除铁”时加入H2O2可将“酸溶”后溶液中的Fe2+氧化为Fe3+;为证明添加的H2O2已足量,主要验证亚铁离子反应完全,选择铁氰化钾溶液进行检验;
⑶据流程图可知,“除铜”时加入的沉淀剂为H2S,用Na2S代替H2S除铜,不产生易挥发污染性气体H2S;
⑷已知除杂过程在陶瓷容器中进行,除铜后的滤液应显酸性,若NaF的用量过大,过量的F-会生成氢氟酸腐蚀陶瓷容器;
⑸镍氢电池放电时,正极上NiOOH得电子发生还原反应,再写出电极反应式;
⑹①滴定过程中,有碘单质参与反应,故应选择淀粉溶液做指示剂;
②建立关系式先求出n(Fe3+),再根据沉淀得出硫酸根的物质的量,再求出m(Na+)+m(OH-)质量,根据化合价代数和为0可得,得n(Na+)、n(OH-),最后求出答案。
⑴已知Ni难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还边搅拌边缓慢加入了稀硝酸,反应有N2生成,则Ni溶解的离子方程式:5Ni+12H++2NO3-= 5Ni2++N2↑+6H2O;
故答案为:5Ni+12H++2NO3-= 5Ni2++N2↑+6H2O;
⑵H2O2具有氧化性,“除铁”时加入H2O2可将“酸溶”后溶液中的Fe2+氧化为Fe3+。为证明添加的H2O2已足量,可选择铁氰化钾溶液进行检验:若H2O2用量不足,溶液中残余的Fe2+会与铁氰化钾溶液反应产生蓝色沉淀;反之可说明H2O2足量;
故答案为:将Fe2+氧化为Fe3+;铁氰化钾;
⑶据流程图可知,“除铜”时加入的沉淀剂为H2S,对应的离子方程式为H2S+Cu2+=CuS↓ + 2H+;若用Na2S代替H2S除铜,不产生易挥发污染性气体H2S;
故答案为:H2S+Cu2+=CuS↓+2H+;不产生易挥发污染性气体H2S;
⑷已知除杂过程在陶瓷容器中进行,且据流程图可知除铜后的滤液应显酸性,所以若NaF的用量过大,过量的F-会生成氢氟酸腐蚀陶瓷容器;
故答案为:过量的F-会生成氢氟酸腐蚀陶瓷容器;
⑸镍氢电池放电时,正极上NiOOH得电子发生还原反应,电极反应式为NiOOH + H2O + e-= Ni(OH)2 + OH-;
故答案为:NiOOH + H2O + e-= Ni(OH)2 + OH-;
⑹①滴定过程中,有碘单质参与反应,故应选择淀粉溶液做指示剂;滴定达到终点时的颜色变化为:溶液蓝色恰好褪去,且半分钟内不再恢复;
故答案为:淀粉溶液;当溶液蓝色恰好褪去,且半分钟内不再恢复;
②加入足量的KI,反应为2Fe3++2I-= 2Fe2++I2,根据I2+2Na2S2O3=2NaI+Na2S4O6得出关系式为:Fe3+~Na2S2O3,则100.00mL中n(Fe3+)=0.25mol/L×0.03L×10 = 0.03mol;1.165g为硫酸钡,则100.00mL中![]() ,则y:m=3:2,m(Fe3+)+m(SO42-) =1.68g+1.92g = 3.6g,m(Na+)+m(OH-)=4.850g-3.6g=1.25g,根据化合价代数和为0可得,n(Na+)+n(OH-)=0.07mol,解得n(Na+)=0.01mol,n(OH-) =0.06mol,则x:y:m:n=1:3:2:6,故黄钠铁矾的化学式为NaFe3(SO4)2(OH)6;
,则y:m=3:2,m(Fe3+)+m(SO42-) =1.68g+1.92g = 3.6g,m(Na+)+m(OH-)=4.850g-3.6g=1.25g,根据化合价代数和为0可得,n(Na+)+n(OH-)=0.07mol,解得n(Na+)=0.01mol,n(OH-) =0.06mol,则x:y:m:n=1:3:2:6,故黄钠铁矾的化学式为NaFe3(SO4)2(OH)6;
故答案为:NaFe3(SO4)2(OH)6。