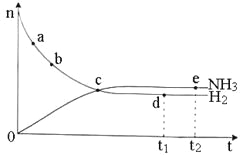
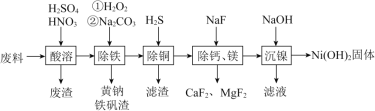
题目内容
【题目】(1)Fe元素在元素周期表中位于______区,基态Fe2+的离子结构示意图为_____________。
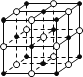
(2)氧化亚铁晶体的晶胞如下图所示。已知:氧化亚铁晶体的密度为ρg·cm-3(NA代表阿伏加德罗常数的值)。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2-的最短核间距为_____________cm。
(3)金属晶体Ti采取面心立方最密堆积,则Ti原子的空间利用率是 : ________π×100%(要求写出带根号的最简计算式)。
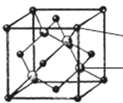
(4)SiC晶体的硬度为9.5,其晶胞结构如下图所示(小球代表C原子,大球代表Si原子);则该晶体类型为_________,在SiC晶体中,每个Si原子周围最近的C原子数目为________个;若晶胞的边长为a pm(NA代表阿伏加德罗常数的值),则该晶体的密度表达式为_______________g/cm3(化为最简形式 )。冰晶胞中水分子的空间排列方式与上述晶胞_______(填“相似”或“不相似”)。
【答案】d区 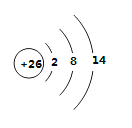 12
12 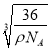
![]() 原子 4
原子 4 ![]() 相似
相似
【解析】
(1)根据构造原理写出铁原子的电子排布式,据此作答。
(2)FeO晶包为正方体,根据均摊法可计算每个晶胞中含Fe2+和O2-均为4个,假设黑球为Fe2+,Fe2+处于顶点和面心,白球为O2-,O2-处于棱心和体心,据此可求出与Fe2+紧邻且等距离的Fe2+数目及Fe2+与O2-的最短核间距。
(3)面心立方最密堆积的晶包为 ,同一面上处于对角线上的三个Ti原子相切,设Ti原子半径为r,晶包边长为a,求出一个晶胞中Ti原子个数,进一步求出所有Ti原子的体积,再求出晶胞的体积,两者相比可得空间利用率。
,同一面上处于对角线上的三个Ti原子相切,设Ti原子半径为r,晶包边长为a,求出一个晶胞中Ti原子个数,进一步求出所有Ti原子的体积,再求出晶胞的体积,两者相比可得空间利用率。
(4)SiC硬度大,属于原子晶体。根据晶胞结构特点,求出晶胞的体积和晶胞中所含有的SiC的质量,即可求出密度。H2O子中的O和SiC中C均采取sp3杂化,H2O可与周围的4个H2O形成4个氢键,据此回答。
(1)Fe的电子排布式为1s22s22p63s23p63d64s2,最后一个电子填充在3d能级上,所以Fe属于d区元素,Fe2+的离子结构示意图为 。
。
(2)假设黑球为Fe2+,则Fe2+位于正方体的顶点和面心,处于同一个面上的顶点的Fe2+与面心的Fe2+的距离最短,因而一个晶胞上与顶点的Fe2+最近的Fe2+有3个,一个顶点属于8个晶胞共用,面心的一个Fe2+属于两个晶胞共用,因此与顶点上的Fe2+距离最近的Fe2+有3×8÷2=12个;一个晶胞中含有的Fe2+的个数为8×![]() +6×
+6×![]() =4,O2-个数也为4个,故一个晶胞中FeO的质量为
=4,O2-个数也为4个,故一个晶胞中FeO的质量为![]() g,设晶胞的边长为acm,则晶胞的体积为a3,所以有
g,设晶胞的边长为acm,则晶胞的体积为a3,所以有![]() =a3ρ,故a= (
=a3ρ,故a= (![]() )1/3,Fe2+与O2-的最短核间距为晶胞边长的一半,故Fe2+与O2-的最短核间距为
)1/3,Fe2+与O2-的最短核间距为晶胞边长的一半,故Fe2+与O2-的最短核间距为![]() =
=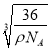 ;
;
(3)面心立方最密堆积的晶包为 ,面对角线上的三个Ti原子相切,设Ti原子半径为r,则面对角线长为4r,所以晶包边长为2
,面对角线上的三个Ti原子相切,设Ti原子半径为r,则面对角线长为4r,所以晶包边长为2![]() r,晶胞的体积为(2
r,晶胞的体积为(2![]() r)3,一个Ti原子的体积为
r)3,一个Ti原子的体积为![]() ,一个晶胞中含有Ti原子数目为4,所以空间利用率为
,一个晶胞中含有Ti原子数目为4,所以空间利用率为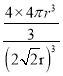 =
=![]() ;
;
(4)SiC的硬度大且为共价键形成的化合物,故属于原子晶体;由图可知每个Si原子与四个碳原子形成四个共价键,构成一个四面体结构,故每个Si原子周围最近的C原子数目为4个;一个晶胞中含碳原子个数为4,Si原子个数为4,故一个晶胞中SiC的质量为![]() =160/NA,晶胞的体积为(a×10-10)3,所以ρ=
=160/NA,晶胞的体积为(a×10-10)3,所以ρ=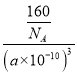 =
=![]() ;H2O子中的O和SiC中的Si均采取sp3杂化,SiC中Si与C形成四个共价键,一个H2O与周围的4个H2O能形成4个氢键,氢键具有方向性,故冰晶胞中水分子的空间排列方式与SiC的晶胞相似。
;H2O子中的O和SiC中的Si均采取sp3杂化,SiC中Si与C形成四个共价键,一个H2O与周围的4个H2O能形成4个氢键,氢键具有方向性,故冰晶胞中水分子的空间排列方式与SiC的晶胞相似。