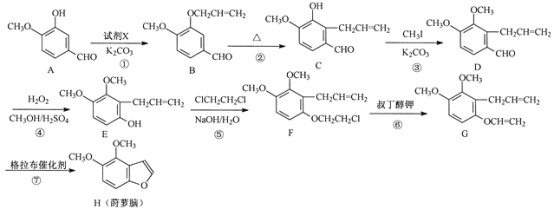
题目内容
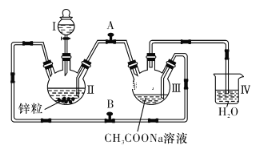
【题目】将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是( )
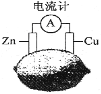
A.将电能转换为化学能
B.电子由铜片流出经导线到锌
C.一段时间后,锌片质量减轻
D.铜片一侧柠檬变蓝色,产生Cu2+
【答案】C
【解析】
A. 该装置可将化学能转化为电能;
B. 原电池中电子由负极流向正极;
C. 原电池中Zn为负极,发生氧化反应;
D. 原电池中Zn为负极,失电子变为Zn2+,Cu为正极,电解质中的H+得电子生成H2。
A. 该装置可将化学能转化为电能,是原电池,A项错误;
B. 原电池中Zn为负极,Cu为正极,电子由负极流向正极,因此电子由锌片流出经导线到铜片,B项错误;
C. 原电池中Zn为负极,发生氧化反应,锌片逐渐溶解,质量减轻,C项正确;
D. 原电池中Cu为正极,电解质中的H+得电子生成H2,D项错误;
答案选C。

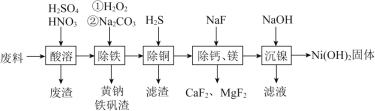
【题目】铈(Ce)是![]() 种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
⑴滤渣的成分是________,反应②的离子方程式是________。
⑵干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ce(OH)4的数据如下表:
干法空气氧化法 | 氧化温度 | 氧化率 | 氧化时间 |
暴露空气中 | 110~120 | 90 | 18 |
在对流空气氧化炉中 | 110~120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
⑶利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3(如图):阳极电极反应式为________,离子交换膜为________(填“阴”或“阳”)离子交换膜。
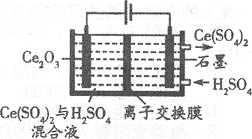
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式________。