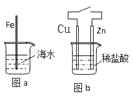
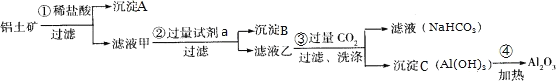
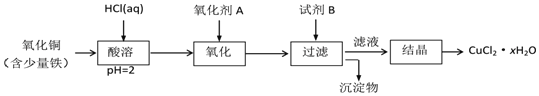
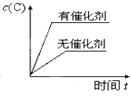
题目内容
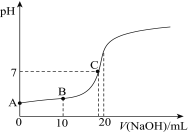
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
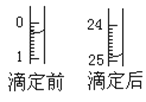
(1)用___式滴定管盛装cmol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是___。如图表示某次滴定时50mL滴定管中前后液面的位置。滴定管读数时应注意___。用去的标准盐酸的体积是___mL。
(2)该实验应选用__(填“酚酞”或者“石蕊”)作指示剂;操作中如何确定终点?__。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果___;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___;
C,读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果___。
【答案】酸 容量瓶 读数时,眼睛应平视液体凹液面的最低点;读数应到0.01mL 24.60 酚酞 滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色 无影响 偏高 偏低
【解析】
(1)酸性溶液存放在酸式滴定管中;滴定管读数要估读一位;
(2)根据NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂;
(3)根据c(待测)=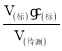 分析不当操作对c(待测)的影响,以此判断浓度的误差;
分析不当操作对c(待测)的影响,以此判断浓度的误差;
(1)盐酸是酸性溶液,存放在酸式滴定管中;配制一定物质的量浓度溶液主要仪器为容量瓶;读数时,眼睛应平视液体凹液面的最低点;读数应到0.01mL;滴定前读数为:0.30mL,滴定后读数为:24.90mL,消耗溶液的体积为24.60mL;故答案为:酸;容量瓶; 读数时,眼睛应平视液体凹液面的最低点;读数应到0.01mL; 24.60;
(2)NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择碱性变色范围内的指示剂酚酞;滴定终点:滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色故答案为:酚酞;滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色;
(3)a.若滴定前用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标)无影响,根据计算公式可知c(待测)无影响;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,造成V(标)偏大,根据计算公式可知可知c(待测)偏高;
c.读数时,若滴定前仰视,滴定后俯视,造成V(标)偏小,根据计算公式可知可知c(待测)偏低;
故答案为:无影响;偏高;偏低

【题目】(1)下列原子或离子的电子排布的表示方法中,正确的是___,违反了能量最低原理的是___,违反洪特规则的是__。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:![]()
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦C:![]()
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(2)基态Al原子中,电子填充的最高能级是___,基态Cr原子的价电子排布式是___。
(3)用“>”或“<”填空:
第一电离能 | 沸点 | 离子半径 |
Be___B | H2S___H2O | Al3+___O2- |
(4)卟啉与Fe2+合即可形成血红素,Fe2+的电子排布式为___,铁在周期表中的位置为__。