题目内容
【题目】![]() 铝土矿
铝土矿![]() 主要成分为
主要成分为![]() ,还含有
,还含有![]() 、
、![]() 是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
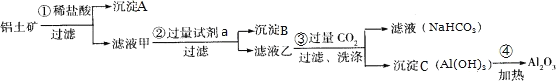
①沉淀A成分是______;步骤![]() 中的试剂a是______;
中的试剂a是______;![]() 以上均填化学式
以上均填化学式![]() ;
;
②简述检验所得滤液甲中存在![]() 的操作方法:______;
的操作方法:______;
![]() 用含少量铁的氧化铜制取氯化铜晶体
用含少量铁的氧化铜制取氯化铜晶体![]() 。有如下操作:
。有如下操作:
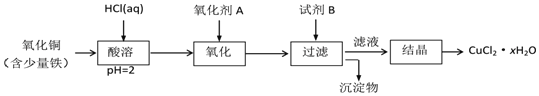
已知:在pH为![]() 时,
时,![]() 几乎完全转化为
几乎完全转化为![]() 沉淀,
沉淀,![]() 却不反应。
却不反应。
①氧化剂A可选用______ ![]() 填编号,下同
填编号,下同![]() ;
;
A.![]()
![]()
![]()
![]() 浓盐酸
浓盐酸
②试剂B可选用______;
A.NaOH ![]()
![]()
![]()
③试剂B的作用是______;
A.使![]() 完全沉淀
完全沉淀![]() 使
使![]() 完全沉淀
完全沉淀 ![]() 提高溶液的pH
提高溶液的pH ![]() 除去过量的氧化剂
除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是______。
【答案】![]() NaOH 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有
NaOH 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有![]() ,否则不含
,否则不含![]() C B BC 蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C B BC 蒸发浓缩、冷却结晶、过滤、洗涤、干燥
【解析】
(1)铝土矿中加入过量稀盐酸,过滤得到沉淀A和滤液甲,沉淀A为SiO2,滤液甲中加入过量试剂a为NaOH溶液,过滤分离出沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过量二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝生成氧化铝;
(2)含少量铁的氧化铜中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑、CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,除杂时不能引入新的杂质,A可能为过氧化氢或氯气等;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,B为CuO等,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,以此来解答。
(1)①由上述分析可知,沉淀A为SiO2,步骤②中的试剂a是NaOH;
②检验所得滤液甲中存在Fe3+的操作方法为取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+;
(2)①氧化剂A可选用氯气,其它选项均引入新杂质,故答案为:C;
②试剂B可选用CuO,其它选项均引入新的离子,故答案为:B;
③试剂B的作用是使Fe3+完全沉淀、提高溶液的pH,故答案为:BC;
④从滤液经过结晶得到氯化铜晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。