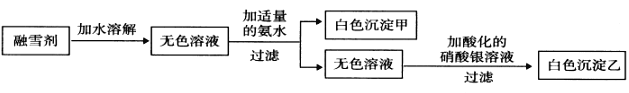
题目内容
【题目】(1)下列原子或离子的电子排布的表示方法中,正确的是___,违反了能量最低原理的是___,违反洪特规则的是__。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:![]()
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦C:![]()
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(2)基态Al原子中,电子填充的最高能级是___,基态Cr原子的价电子排布式是___。
(3)用“>”或“<”填空:
第一电离能 | 沸点 | 离子半径 |
Be___B | H2S___H2O | Al3+___O2- |
(4)卟啉与Fe2+合即可形成血红素,Fe2+的电子排布式为___,铁在周期表中的位置为__。
【答案】①⑤⑥ ② ③④⑦ 3p 3d54s1 > < < 1s22s22p63s23p63d6 第四周期第Ⅷ族
【解析】
(1)根据构造原理确定核外电子排布式是否正确,能量最低原理:原子核外电子先占有能量较低的轨道.然后依次进入能量较高的轨道;泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态 相反的电子;洪特规则:在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同。
(2)根据核外电子排布规律可以写出价电子排布式,根据充满和半充满状态能量最低也是最稳定的状态进行分析;
(3)Be、B同周期自左而右元素的第一电离能呈增大趋势,ⅡA族反常;水分子间含有氢键;核外电子数相同的,原子序数越大,半径越小;
(4)Fe是26号元素,其原子核外有26个电子,失去两个最外层电子生成亚铁离子,根据构造原理书写其核外电子排布式;
(1)①正确;②违反了能力最低原子;③违反了洪特规则;④违反了洪特原则;⑤正确;⑥正确;⑦违反了洪特规则;故答案为:①⑤⑥;②;③④⑦;
(2)Al为13号元素,其电子排布式为1s22s22p63s23p1,最高能级为3p,根据核外电子排布规律可以写出基态铬价电子排布式为1s22s22p63s23p63s23p63d54s1,所以基态铬(Cr)原子的价电子排布式是3d54s1,故答案为:3p;3d54s1;
(3)同周期自左而右元素的第一电离能呈增大趋势,但ⅡA族最外层为ns能级容纳2个电子,为全满确定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能B<Be;水分子间含有氢键,使得水的分子间作用力大于硫化氢分子的,故水的沸点大;电子层数越多半径越大,核外电子数相同的,原子序数越大,半径越小,O2-、Al3+有2个电子层,O的原子序数小所以O2-半径比Al3+大,所以离子半径O2->Al3+,故答案为:>;<;<;
(4)Fe是26号元素,其原子核外有26个电子,失去两个最外层电子生成亚铁离子,根据构造原理书写其核外电子排布式为1s22s22p63s23p63d6,铁元素在元素周期表的位置为第四周期第Ⅷ族,故答案为:1s22s22p63s23p63d6;第四周期第Ⅷ族。

【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
【题目】下列实验操作与预期实验目的或所得实验结论一致的是![]()
选项 | 实验操作 | 实验目的或结论 |
A | 向含有少量 | 除去 |
B | 向某溶液中加入 | 证明溶液中含 |
C | 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊 | 证明该溶液中存在 |
D | 向 | 证明 |
A.AB.BC.CD.