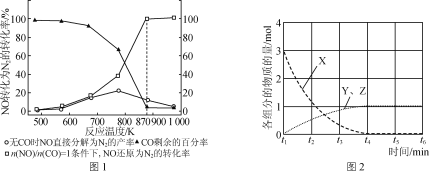
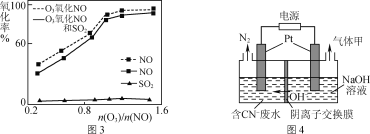
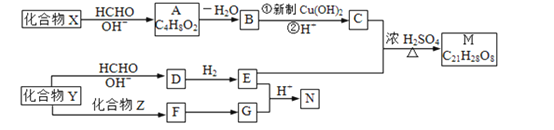
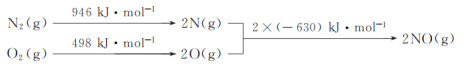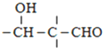题目内容
【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0
【答案】D
【解析】
A.依据表中数据可知,该反应在T℃时反应速率快,达到平衡状态时n(Cl2)增大,则T>400,故A错误;
B.反应在0~40min内,反应未达到平衡,正反应速率大于逆反应速率,反应向正反应方向进行,所以Q<K,故B错误;
C. 120min时,反应达到平衡状态,根据数据,在400℃时,甲容器平衡后0.8mol,乙容器中1.00mol,达到平衡时间短说明反应速率快,所以甲、乙容器中NH3的ν(正)不相等,故C错误;
D.根据数据,在400℃时,甲容器平衡后0.8mol,乙容器中1.00mol,达到平衡时间短说明反应速率快,乙中剩余氯气应少,但氯气增多说明温度升高影响平衡逆向进行,逆向为吸热反应,正向为放热反应,则反应的△H<0,故D正确。
故选D。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目