题目内容
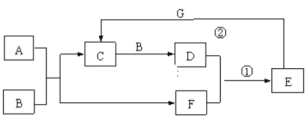
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)。回答下列问题:
⑴A的电子式为__________。
⑵反应①的化学方程式为_______,该反应的氧化剂和还原剂的物质的量之比为________;
⑶反应②的离子方程式为_______________。
【答案】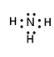 3NO2+H2O=2HNO3+NO 1
3NO2+H2O=2HNO3+NO 1![]() 2 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
2 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
【解析】
由题干信息可知,B是能使带火星的木条复燃的无色无味气体,则B是氧气,G是一种紫红色金属单质,则G是铜,A是常见气态氢化物,且能和氧气反应,所以根据图中的转化课判断,A可能是氨气,则C就是NO,F是水,NO和氧气反应生成NO2,NO2溶于水生成硝酸,则E是硝酸,其相对分子质量比NO2大17,硝酸和铜反应又生成NO,据此分析解答。
(1)根据上述分析可知,A为氨气,为共价化合物,分子中N原子和H原子形成共价键,其电子式为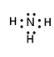 ,故答案为:
,故答案为: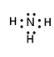 ;
;
(2)反应①为NO2溶于水生成硝酸,反应方程式为3NO2+H2O=2HNO3+NO,反应为歧化反应,3molNO2中2mol失去电子作还原剂,1mol得到电子作氧化剂,则该反应的氧化剂和还原剂的物质的量之比为1![]() 2,故答案为:3NO2+H2O=2HNO3+NO;1
2,故答案为:3NO2+H2O=2HNO3+NO;1![]() 2;
2;
(3)反应②为硝酸和铜反应生成NO,反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O。

【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0