题目内容
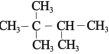
【题目】固体粉末 X 中可能含有 Fe2O3、CuO、MnO2、CaO、NaCl 和 K2CO3 中的若干种。为确定该固体粉末的成分,进行了以下实验(所加试剂均过量):
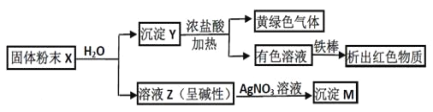
下列结论正确的是:
A. 固体粉末中一定含 K2CO3B. X 中可能存在 Fe2O3
C. 沉淀 M 一定含 AgClD. 沉淀 Y 中不一定存在 MnO2
【答案】B
【解析】
A.固体粉末X中加入水,有难溶性的固体Y,也有可溶性的液体Z,该溶液显碱性,可能是CaO溶于水,与水反应产生的Ca(OH)2电离导致,也可能是 K2CO3 水解使溶液显碱性,A不合理;
B.若固体粉末 X 中含有 Fe2O3,该物质不溶于水,向其中加入盐酸,发生反应产生FeCl3和水,该盐的水溶液显黄色,从而得到有色溶液,B正确;
C.向溶液Z中加入AgNO3溶液,产生沉淀M,可能是Ag2CO3,也可能是AgCl,C错误;
D.向不溶于水的固体中加入浓盐酸,发生反应,产生黄绿色气体,是由于发生反应:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,可以证明沉淀 Y 中一定存在MnO2,D错误;
MnCl2+Cl2↑+2H2O,可以证明沉淀 Y 中一定存在MnO2,D错误;
故合理选项是B。

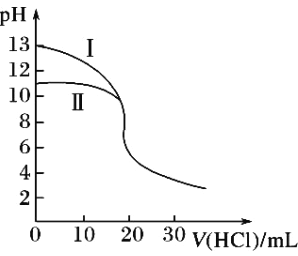
【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0
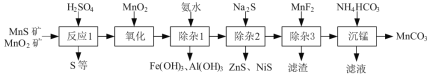
【题目】(一种由天然MnO2矿与MnS矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
⑴“反应1”中MnO2与MnS反应的化学方程式为______。
⑵“反应1”后所得沉淀物中除S外,一定还含有的氧化物是______(填化学式)。
⑶“除杂2”后溶液中c(Zn2+)=1×105 mol·L1,则溶液中c(Ni2+)=______mol·L1。[已知:Ksp(ZnS)=2×1022,Ksp(NiS)=1×1024]
⑷“滤渣”的成分为______(填化学式);“滤液”中所含溶质的主要成分为___(填化学式)。
⑸将部分MnCO3溶于稀硫酸,所得溶液电解可制得MnO2循环使用。写出电解时所发生反应的离子方程式:______。
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在 100 mL 稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在 0~1、1~2、2~3、3~4、4~5 min 各时间段中:反应速率最大的时间段是_______________; 在 0~5min 内,反应速率变化的原因是______________________________________________________________________________________
(2)在 2~3 min 时间段内,用盐酸的浓度变化表示的反应速率为_______________
(3)为了减缓反应速率但不减少产生气的量,在盐酸中分别加入等体积的下列液体:
A.蒸馏水 B.Na2SO4 溶液 C.NaOH 溶液 D.H2SO4 溶液 E.Na2CO3
你认为可行的是(填编号)_______________。
(4)为了加快锌和盐酸的反应,采用了如图的装置。

此装置中负极为_______________,写出正极的电极反应式______________;
若收集到标况下 2.24L 气体,转移了电子_______________________mol,溶解了Zn______________g.