题目内容
【题目】如图所示,是原电池的装置图。请回答:
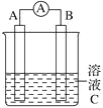
(1)若C为氯化铁溶液,电流表指针发生偏转,A、B电极材料分别为铜和银,则B电极上发生的电极反应式为_______________;
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
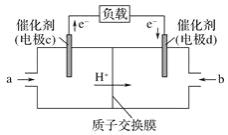
电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_极,电极反应方程式为__。若线路中转移6mol电子,则消耗的O2在标准状况下的体积为____ L。
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)。该蓄电池放电时,电解质溶液中 SO42-移向______(填“正”或“负”)极;正极电极反应方程式为____________;一段时间后,负极增重 48g,转移电子_____mol。
【答案】Fe3++e-= Fe2+ 负 CH3OH-6e-+H2O=CO2+6H+ 33.6 负 PbO2+2e-+SO42-+4H+=PbSO4+2H2O 1
【解析】
分析原电池正负极,一般反应的为负极,不反应的为正极,根据图像中电子转移或燃料电池中燃料作负极,根据4mol e- ~ O2计算消耗氧气的物质的量,根据原电池“同性相吸”原理分析溶液中离子移动方向,铅蓄电池中铅作负极,二氧化铅作正极,铅失去电子变为硫酸铅,质量增加。
(1)若C为氯化铁溶液,电流表指针发生偏转,A、B电极材料分别为铜和银,铜和氯化铁反应,银和氯化铁不反应,因此铜为负极,银为正极,因此B电极上发生的电极反应式为Fe3++e-= Fe2+;故答案为:Fe3++e-= Fe2+。
(2)电池总反应为2CH3OH+3O2=2CO2+4H2O,根据图中信息,c电极电子流出,因此c电极为负极,是CH3OH失去电子变为CO2,电极反应方程式为CH3OH 6e- + H2O = CO2+6H+。若线路中转移6mol电子,根据4mol e- ~ O2,因此消耗O2物质的量为1.5mol,则消耗的O2在标准状况下的体积为1.5mol×22.4 L·mol1=33.6L;故答案为:负;CH3OH 6e- + H2O = CO2+6H+;33.6。
(3)铅蓄电池放电时,根据原电池“同性相吸”原理,电解质溶液中 SO42移向负极,根据反应方程式Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)得出Pb为负极,PbO2为正极,正极电极反应方程式为PbO2+2e-+SO42+4H+=PbSO4+2H2O,一段时间后,根据Pb -2e-+SO42 =PbSO4,转移2mol电子,负极质量增加的质量即为1mol硫酸根的质量为96g,因此负极增重48g,转移电子1mol;故答案为:负;PbO2+2e-+SO42+4H+=PbSO4+2H2O;1。

【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0