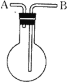题目内容
【题目】曲酸和脱氧曲酸是一种非常有潜力的食品添加剂,结构分别如下图所示。下列有关叙述不正确的是
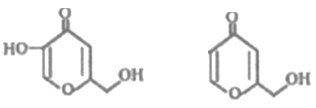
A.曲酸分子中所有碳原子不可能共平面
B.脱氧曲酸能发生酯化反应、氧化反应、还原反应
C.曲酸和脱氧曲酸所含的官能团相同
D.与脱氧曲酸互为同分异构体的芳香族化合物有4种(不考虑O-O键)
【答案】D
【解析】
该分子中含有碳碳双键、醇羟基、醚键、羰基,具有烯烃、醇、醚和酮的性质,能发生加成反应、加聚反应、取代反应等,且碳碳双键、羰基为平面结构,-CH2OH中C为四面体构型,以此来解答。
A.碳碳双键、羰基为平面结构,且直接相连,则所有碳原子可能共面,而-CH2OH中C为四面体构型,分子中所有碳原子不可能共面,故A正确;
B.脱氧曲酸含-OH可发生酯化、氧化反应,含碳碳双键、羰基可发生还原反应,碳碳双键也能发生氧化反应,故B正确;
C.曲酸和脱氧曲酸所含的官能团均包括碳碳双键、羰基和羟基,故C正确;
D.脱氧曲酸的分子式为C6H6O3,该分子的不饱和度=![]() =4,属于芳香族化合物含有3个羟基,符合条件的同分异构体有3种(3个-OH相邻、3个-OH相间、2个-OH相邻且与另1个为间位),故D错误;
=4,属于芳香族化合物含有3个羟基,符合条件的同分异构体有3种(3个-OH相邻、3个-OH相间、2个-OH相邻且与另1个为间位),故D错误;
故答案为D。

【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在 100 mL 稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在 0~1、1~2、2~3、3~4、4~5 min 各时间段中:反应速率最大的时间段是_______________; 在 0~5min 内,反应速率变化的原因是______________________________________________________________________________________
(2)在 2~3 min 时间段内,用盐酸的浓度变化表示的反应速率为_______________
(3)为了减缓反应速率但不减少产生气的量,在盐酸中分别加入等体积的下列液体:
A.蒸馏水 B.Na2SO4 溶液 C.NaOH 溶液 D.H2SO4 溶液 E.Na2CO3
你认为可行的是(填编号)_______________。
(4)为了加快锌和盐酸的反应,采用了如图的装置。

此装置中负极为_______________,写出正极的电极反应式______________;
若收集到标况下 2.24L 气体,转移了电子_______________________mol,溶解了Zn______________g.