题目内容
16.如图是元素周期表的一部分.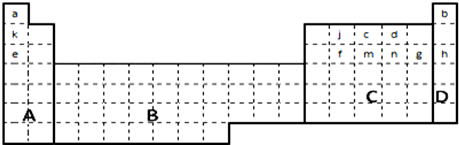
(1)在上面元素周期表中全部是金属元素的区域为B
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①甲元素在元素周期表中位置第三周期ⅢA族
②乙两元素相比较,金属性较强的是Mg,可以验证该结论的实验是BC.
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将这两种元素的单质粉末分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性
③甲的氧化物与e的最高价氧化物对应的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(3)用化学式填空.
①c、f、j的非金属性最强的是N
②以上元素形成的金属单质中,熔点最低金属单质的是Na
③f、m、n、g所形成的氢化物的稳定性最强的是HCl
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为Al3+<Mg2+<Na+<O2-<N3-.
⑤写出工业上制备f元素单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$2CO+Si.
⑥c元素的单质的电子式
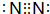 .
.
分析 由元素在周期表中位置,可知a为H、b为He、k为Li、j为C、c为N、d为O、e为Na、f为Si、m为P、n为S、g为Cl、h为Ar.
(1)元素周期表中全部是金属元素的是过渡元素区域;
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,M层电子数为2,故乙为Mg;
(3)①同周期自左而右非金属性增强、同主族自上而下非金属性减弱;
②离子电荷越小、离子半径越大,金属键越弱,金属晶体熔点越低;
③元素的非金属性越强,对应氢化物越稳定;
④电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
⑤工业上用焦炭与二氧化硅反应制备Si,反应还生成CO;
⑥C的单质为N2,分子中N原子之间形成3对共用电子对.
解答 解:由元素在周期表中位置,可知a为H、b为He、k为Li、j为C、c为N、d为O、e为Na、f为Si、m为P、n为S、g为Cl、h为Ar.
(1)A区中含有H元素,C区中含有金属、非金属,D炔区为稀有气体,元素周期表中全部是金属元素的是过渡元素区域,即为B区域,故答案为:B;
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,M层电子数为2,故乙为Mg,
①甲元素在元素周期表中位置:第三周期ⅢA族,故答案为:第三周期ⅢA族;
②同周期自左而右元素金属性减弱,故金属性Mg>Al,
A.在空气中放置已久的这两种元素的块状单质表面均得到氧化镁,氧化铝、氧化镁不溶于水,会阻止金属与热水的反应,故A错误;
B.金属单质与酸反应越剧烈,该金属元素的金属性越强,故B正确;
C.金属镁和热水反应,得到氢氧化镁显弱碱性,而金属铝和热水不反应,可以确定金属性的强弱,故C正确;
D.均为金属氢化物,不能利用气态氢化物稳定性比较金属性强弱,可以比较非金属性强弱,故D错误.
故选:Mg;BC;
③甲的氧化物为Al2O3,e的最高价氧化物对应的水化物为NaOH,二者反应的离子方程式为:,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(3)①同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性N>C>Si,故答案为:N;
②Na、Mg、Al晶体中,Na+离子所带电荷最小、离子半径最大,金属键最弱,故Na晶体熔点最低,故答案为:Na;
③非金属性Cl>S>P>Si,元素的非金属性越强,对应氢化物越稳定,故HCl最稳定,故答案为:GCl;
④电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径为:Al3+<Mg2+<Na+<O2-<N3-,故答案为:Al3+<Mg2+<Na+<O2-<N3-;
⑤工业上用焦炭与二氧化硅反应制备Si,反应还生成CO,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$2CO+Si,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$2CO+Si;
⑥C的单质为N2,分子中N原子之间形成3对共用电子对,电子式为: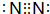 ,故答案为:
,故答案为: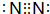 .
.
点评 本题考查元素周期表与元素周期律综合应用,比较基础,注意对元素周期律的理解掌握,注意掌握元素金属性、非金属性强弱比较及实验事实.

| A. | 一定条件下,将1molN2和3molH2混合,充分反应后转移的电子数为NA | |
| B. | 1.5molNO2与足量水反应,转移的电子数为1.5NA | |
| C. | 6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| D. | 常温常压下,11.2LCl2含氯原子数为NA |
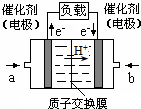 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| C. | 电池负极的反应式为:CH3OH+H2O═CO2+6H++4e- | |
| D. | 电池正极的反应式为:O2+2H2O+4e-═4OH- |
| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
| A. | 据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=2.0×10-12,可推知AgCl溶解度比Ag2CrO4的溶解度大 | |
| B. | 0.1mol/L的ZnCl2溶液中通入足量硫化氢最终得不到ZnS沉淀是因为c(Zn2+)•c(S2-)<Ksp(ZnS) | |
| C. | 向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的大 | |
| D. | AgCl在10 mL 0.1 mol/L的KCl中溶解的质量比在10 mL 0.05 mol/L的AgNO3溶液中少 |
| A. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| B. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{94}^{224}$Pu位于周期表中第六周期 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
