题目内容
10.某同学做完铜、锌、稀硫酸原电池的实验后得出了下列结论,你认为正确的是( )| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 | |
| C. | 负极反应为:2H++2e-═H2↑ | |
| D. | 该装置能将化学能转化为电能 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,硫酸为电解质时,正极析出氢气,原电池的正极可为较不活泼的金属或能导电的非金属,以此解答该题.
解答 解:A.构成原电池正负极的材料不一定都是金属,如锌、石墨和稀硫酸也能构成原电池,故A错误;
B.原电池中,易失电子的金属作负极,所以由铜锌作为电极与硫酸铜溶液组成的原电池中,Zn是负极,故B错误;
C.负极发生氧化反应,应为锌被氧化生成锌离子,负极电极反应为Zn-2e-=Zn2+,在正极上生成氢气,正极反应为2H++2e-═H2↑,故C错误;
D.原电池是将化学能转化为电能的装置,故D正确.
故选D.
点评 本题考查了原电池原理,明确原电池正负极的判断、电子流向、正负极上发生的反应等知识点即可解答,易错选项是A,原电池中正负极电极材料可能都不是金属,如氢氧燃料电池中电极材料都是石墨,为易错点.

练习册系列答案
相关题目
20.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据表中所列键能数据估算a的数值为-93.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
1.下列说法正确的是( )
| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
18.将浓度为0.1mol•L-1CH3COOH溶液加水不断稀释,下列各量始终保持增大的是( )
| A. | c(H+) | B. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | C. | $\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ | D. | Ka(CH3COOH) |
15.A、B是相对分子质量不相等的两种有机物,无论A、B以何种比例混合,只要混合物总质量不变,完全燃烧后,生成水的质量不变.下列各组化合物中不符合这种条件的是( )
| A. | 乙酸和甲酸甲酯 | B. | 乙烯和环己烷 | C. | 甲醛和果糖 | D. | 淀粉和纤维素 |
2.下列微粒中,对水的电离平衡不产生影响的是( )
| A. | 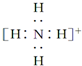 | B. | 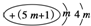 | C. | 26R3+ | D. | 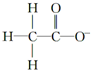 |
19.硼酸(H3BO3)分子的中心原子B最外层电子并未达到饱和,它在水中结合水分子电离出来的OH-使B原子最外层电子达到饱和,电离过程如图所示.下列表述正确的是( )
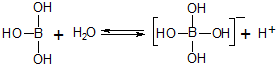
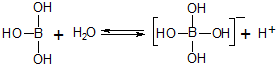
| A. | 硼酸加入水中抑制水的电离 | |
| B. | 硼酸是三元酸 | |
| C. | 硼酸与强碱在溶液中反应:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
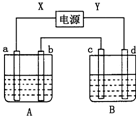 如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.