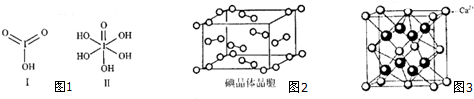
题目内容
1.分析下表中有机物的排列规律,可写出空格上物质的分子式,则横线上能与金属钠反应放出氢气的有机物有(不含立体异构)( )| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 给予的分子符合饱和一元醇或饱和一元醚的通式,能和钠反应生成氢气的只有醇,所以这些物质都是饱和一元醇,饱和一元醇可以可作是支链烷烃中H原子被-OH取代的产物,所以可以根据烷基碳链结构判断饱和一元醇种类,据此分析解答.
解答 解:给予的分子符合饱和一元醇或饱和一元醚的通式,能和钠反应生成氢气的只有醇,所以这些物质都是饱和一元醇,饱和一元醇可以可作是支链烷烃中H原子被-OH取代的产物,所以可以根据烷基碳链结构判断饱和一元醇种类,根据表中数据知,阿拉伯数字序号与饱和一元醇中碳原子个数相等,所以4号位置分子式为C4H10O,烷基-C4H9有 四种碳链结构,所以4号饱和一元醇有4种,故选B.
四种碳链结构,所以4号饱和一元醇有4种,故选B.
点评 本题考查探究化学规律,侧重考查学生分析判断及总结归纳能力,同分异构体类型有官能团异构、碳链异构、官能团位置异构等,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
11.a、b、c、d四个金属电极,有关的实验装置现象如表所示:由此判断这四个电极对应的金属活动性由强到弱的顺序为
( )
( )
| 装置 |  CuSO4溶液 | 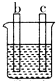 稀硫酸 | 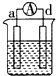 稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
16.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 一定条件下,将1molN2和3molH2混合,充分反应后转移的电子数为NA | |
| B. | 1.5molNO2与足量水反应,转移的电子数为1.5NA | |
| C. | 6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| D. | 常温常压下,11.2LCl2含氯原子数为NA |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA | |
| B. | 标准状况下,0.5 NA 个NO和0.5 NA 个O2混合气体的体积约为22.4 L | |
| C. | 一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA | |
| D. | 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA |
20.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据表中所列键能数据估算a的数值为-93.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
1.下列说法正确的是( )
| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |