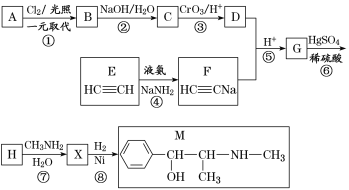
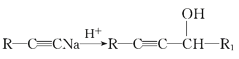
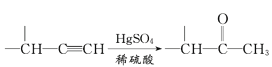
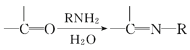
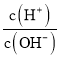ЬтФПФкШн
ЁОЬтФПЁП![]() ОпгаИЦюбПѓаЭНсЙЙЃЌвђОпгагХвьЕФЕчМЋЛЏЬиадЁЂЬњДХадЁЂЗЧДХОјдЕадЕШЖјБИЪмЙизЂЁЃЛиД№ЯТСаЮЪЬтЃК
ОпгаИЦюбПѓаЭНсЙЙЃЌвђОпгагХвьЕФЕчМЋЛЏЬиадЁЂЬњДХадЁЂЗЧДХОјдЕадЕШЖјБИЪмЙизЂЁЃЛиД№ЯТСаЮЪЬтЃК
![]() ЯТСаFдзгЙьЕРБэДяЪНЫљБэЪОЕФзДЬЌЃЌФмСПгЩИпЕНЕЭЕФЫГађе§ШЗЕФЪЧ_______
ЯТСаFдзгЙьЕРБэДяЪНЫљБэЪОЕФзДЬЌЃЌФмСПгЩИпЕНЕЭЕФЫГађе§ШЗЕФЪЧ_______![]() ЬюбЁЯюзжФИ
ЬюбЁЯюзжФИ![]() ЁЃ
ЁЃ
![]()
A.![]()
![]()
![]()
![]()
![]() ЯрЭЌбЙЧПЯТЃЌHFЁЂHClЁЂHBrЕФЗаЕугЩИпЕНЕЭЕФЫГађЮЊ_________ЃЌдвђЮЊ_______ЁЃ
ЯрЭЌбЙЧПЯТЃЌHFЁЂHClЁЂHBrЕФЗаЕугЩИпЕНЕЭЕФЫГађЮЊ_________ЃЌдвђЮЊ_______ЁЃ
![]() дЊЫиПЩаЮГЩЖржжживЊЛЏКЯЮяЃЌШч
дЊЫиПЩаЮГЩЖржжживЊЛЏКЯЮяЃЌШч![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕШЁЃЦфжа
ЕШЁЃЦфжа![]() ЕФVSEPRФЃаЭЮЊ_____________ЃЛ
ЕФVSEPRФЃаЭЮЊ_____________ЃЛ![]() жаNдзгЕФдгЛЏаЮЪНЮЊ__________ЃЛ
жаNдзгЕФдгЛЏаЮЪНЮЊ__________ЃЛ![]() жа
жа![]() Мќгы
Мќгы![]() МќЕФЪ§ФПжЎБШЮЊ_________ЁЃ
МќЕФЪ§ФПжЎБШЮЊ_________ЁЃ
![]() зщГЩ
зщГЩ![]() ЕФдзгЕФЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЮЊ___________
ЕФдзгЕФЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЮЊ___________![]() гУдЊЫиЗћКХБэЪО
гУдЊЫиЗћКХБэЪО![]() ЃЛЦфжаШ§жждзгЛљЬЌЪБЫљКЌЮДГЩЖдЕчзгЪ§зюЖрЕФЪЧ_________
ЃЛЦфжаШ§жждзгЛљЬЌЪБЫљКЌЮДГЩЖдЕчзгЪ§зюЖрЕФЪЧ_________![]() ЬюдЊЫиЗћКХ
ЬюдЊЫиЗћКХ![]() ЁЃ
ЁЃ
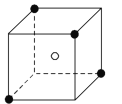
![]() ЕФСЂЗНОЇАћНсЙЙШчЭМЫљЪОЃЌЦфжа
ЕФСЂЗНОЇАћНсЙЙШчЭМЫљЪОЃЌЦфжа![]() ВЩгУМђЕЅСЂЗНЖбЛ§ЁЃ
ВЩгУМђЕЅСЂЗНЖбЛ§ЁЃ

![]() гы
гы![]() НєСкЕФFдзгИіЪ§ЮЊ__________ЁЃ
НєСкЕФFдзгИіЪ§ЮЊ__________ЁЃ
![]() ШєОЇАћВЮЪ§ЮЊ
ШєОЇАћВЮЪ§ЮЊ![]() ЃЌАЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊ
ЃЌАЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊ![]() ЃЌдђОЇЬхУмЖШЮЊ_______
ЃЌдђОЇЬхУмЖШЮЊ_______![]() гУКЌaЁЂ
гУКЌaЁЂ![]() ЕФДњЪ§ЪНБэЪО
ЕФДњЪ§ЪНБэЪО![]() ЁЃ
ЁЃ
ЁОД№АИЁП![]()
![]() HFЗжзгМфФмаЮГЩЧтМќЃЌHBrБШHClЕФЯрЖдЗжзгжЪСПДѓЃЌЗжзгМфзїгУСІДѓ ЫФУцЬхаЮ
HFЗжзгМфФмаЮГЩЧтМќЃЌHBrБШHClЕФЯрЖдЗжзгжЪСПДѓЃЌЗжзгМфзїгУСІДѓ ЫФУцЬхаЮ ![]()
![]()
![]() Co
Co ![]()
![]()
ЁОНтЮіЁП
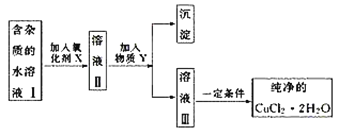
![]() КЭ
КЭ![]() ОљЮЊЛљЬЌFдзгЕФЙьЕРБэДяЪНЃЌ
ОљЮЊЛљЬЌFдзгЕФЙьЕРБэДяЪНЃЌ![]() ЮЊ1Иі1sЕчзгдОЧЈЕН3pФмМЖЃЌ
ЮЊ1Иі1sЕчзгдОЧЈЕН3pФмМЖЃЌ![]() ЮЊ1Иі2sЕчзгдОЧЈЕН3sФмМЖЃЛ
ЮЊ1Иі2sЕчзгдОЧЈЕН3sФмМЖЃЛ
![]() HFЗжзгМфФмаЮГЩЧтМќЃЌЦфЗаЕуЯрЖдЦфЫћТБЛЏЧтвЊИпЃЌHBrБШHClЕФЯрЖдЗжзгжЪСПДѓЃЌЗжзгМфзїгУСІДѓЃЌЫљвдHBrЕФЗаЕуНЯИпЃЛ
HFЗжзгМфФмаЮГЩЧтМќЃЌЦфЗаЕуЯрЖдЦфЫћТБЛЏЧтвЊИпЃЌHBrБШHClЕФЯрЖдЗжзгжЪСПДѓЃЌЗжзгМфзїгУСІДѓЃЌЫљвдHBrЕФЗаЕуНЯИпЃЛ
![]() жаOдзгЕФМлВуЕчзгЖдЪ§ФПЮЊ4ЃЛ
жаOдзгЕФМлВуЕчзгЖдЪ§ФПЮЊ4ЃЛ![]() жаNдзгЕФМлВуЕчзгЖдЪ§ЮЊ4ЃЛ
жаNдзгЕФМлВуЕчзгЖдЪ§ЮЊ4ЃЛ![]() ЕФНсЙЙЪНЮЊ
ЕФНсЙЙЪНЮЊ ЃЛ
ЃЛ
![]() жаFдЊЫиЕФЗЧН№ЪєадзюЧПЃЌKдЊЫиЕФН№ЪєадзюЧПЃЛЛљЬЌKдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ1ЃЌЛљЬЌCoдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ3ЃЌЛљЬЌFдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ1ЃЛ
жаFдЊЫиЕФЗЧН№ЪєадзюЧПЃЌKдЊЫиЕФН№ЪєадзюЧПЃЛЛљЬЌKдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ1ЃЌЛљЬЌCoдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ3ЃЌЛљЬЌFдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ1ЃЛ
![]() гЩОЇАћНсЙЙЭМжЊЃЌ
гЩОЇАћНсЙЙЭМжЊЃЌ![]() ДІгкОЇАћЖЅЕуЮЛжУЃЌFдзгДІгкОЇАћУцаФЮЛжУЃЛ
ДІгкОЇАћЖЅЕуЮЛжУЃЌFдзгДІгкОЇАћУцаФЮЛжУЃЛ
![]() ЯШШЗЖЈОЇАћЕФзщГЩЃЌдйШЗЖЈОЇАћЕФжЪСПЃЌдйНсКЯУмЖШ
ЯШШЗЖЈОЇАћЕФзщГЩЃЌдйШЗЖЈОЇАћЕФжЪСПЃЌдйНсКЯУмЖШ![]() МЦЫуЁЃ
МЦЫуЁЃ
![]() КЭ
КЭ![]() ОљЮЊЛљЬЌFдзгЕФЙьЕРБэДяЪНЃЌ
ОљЮЊЛљЬЌFдзгЕФЙьЕРБэДяЪНЃЌ![]() ЮЊ1Иі1sЕчзгдОЧЈЕН3pФмМЖЃЌ
ЮЊ1Иі1sЕчзгдОЧЈЕН3pФмМЖЃЌ![]() ЮЊ1Иі2sЕчзгдОЧЈЕН3sФмМЖЃЌЙЪ
ЮЊ1Иі2sЕчзгдОЧЈЕН3sФмМЖЃЌЙЪ![]() БШ
БШ![]() ФмСПИпЃЌ
ФмСПИпЃЌ![]() БШ
БШ![]() ЁЂ
ЁЂ![]() ФмСПИпЃЌдђФмСПгЩИпЕНЕЭЫГађЮЊ
ФмСПИпЃЌдђФмСПгЩИпЕНЕЭЫГађЮЊ![]() ЃЌЙЪД№АИЮЊDЃЛ
ЃЌЙЪД№АИЮЊDЃЛ
![]() HFЗжзгМфФмаЮГЩЧтМќЃЌЦфЗаЕуЯрЖдЦфЫћТБЛЏЧтвЊИпЃЌHBrБШHClЕФЯрЖдЗжзгжЪСПДѓЃЌЗжзгМфзїгУСІДѓЃЌЫљвдHBrЕФЗаЕуНЯИпЃЌЫљвдЗаЕугЩИпЕНЕЭЫГађЮЊ
HFЗжзгМфФмаЮГЩЧтМќЃЌЦфЗаЕуЯрЖдЦфЫћТБЛЏЧтвЊИпЃЌHBrБШHClЕФЯрЖдЗжзгжЪСПДѓЃЌЗжзгМфзїгУСІДѓЃЌЫљвдHBrЕФЗаЕуНЯИпЃЌЫљвдЗаЕугЩИпЕНЕЭЫГађЮЊ![]() ЃЛ
ЃЛ
![]() жаOдзгЕФМлВуЕчзгЖдЪ§ФПЮЊ4ЃЌVSEPRФЃаЭЮЊЫФУцЬхаЮЃЛ
жаOдзгЕФМлВуЕчзгЖдЪ§ФПЮЊ4ЃЌVSEPRФЃаЭЮЊЫФУцЬхаЮЃЛ![]() жаNдзгЕФМлВуЕчзгЖдЪ§ЮЊ4ЃЌЦфдгЛЏаЮЪНЮЊ
жаNдзгЕФМлВуЕчзгЖдЪ§ЮЊ4ЃЌЦфдгЛЏаЮЪНЮЊ![]() ЃЛ
ЃЛ![]() ЕФНсЙЙЪНЮЊ
ЕФНсЙЙЪНЮЊ ЃЌЦфжа
ЃЌЦфжа![]() Мќгы
Мќгы![]() МќЕФЪ§ФПжЎБШЮЊ5ЃК1ЃЛ
МќЕФЪ§ФПжЎБШЮЊ5ЃК1ЃЛ
![]() жаFдЊЫиЕФЗЧН№ЪєадзюЧПЃЌKдЊЫиЕФН№ЪєадзюЧПЃЌЙЪЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЮЊ
жаFдЊЫиЕФЗЧН№ЪєадзюЧПЃЌKдЊЫиЕФН№ЪєадзюЧПЃЌЙЪЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЮЊ![]() ЃЛЛљЬЌKдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ1ЃЌЛљЬЌCoдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ3ЃЌЛљЬЌFдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ1ЃЌЙЪЮДГЩЖдЕчзгЪ§зюЖрЕФЪЧCoдзгЃЛ
ЃЛЛљЬЌKдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ1ЃЌЛљЬЌCoдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ3ЃЌЛљЬЌFдзгЕФЮДГЩЖдЕчзгЪ§ЮЊ1ЃЌЙЪЮДГЩЖдЕчзгЪ§зюЖрЕФЪЧCoдзгЃЛ
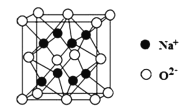
![]() гЩОЇАћНсЙЙЭМжЊЃЌ
гЩОЇАћНсЙЙЭМжЊЃЌ![]() ДІгкОЇАћЖЅЕуЮЛжУЃЌFдзгДІгкОЇАћУцаФЮЛжУЃЌЙЪгы
ДІгкОЇАћЖЅЕуЮЛжУЃЌFдзгДІгкОЇАћУцаФЮЛжУЃЌЙЪгы![]() НєСкЕФFдзгИіЪ§ЮЊ12ЃЛ
НєСкЕФFдзгИіЪ§ЮЊ12ЃЛ
![]() гЩОЇАћНсЙЙПЩжЊУПИіОЇАћКЌга1Иі
гЩОЇАћНсЙЙПЩжЊУПИіОЇАћКЌга1Иі![]() ЁЂ1ИіCoдзгЁЂ3ИіFдзгЃЌдђОЇАћЕФжЪСПЮЊ
ЁЂ1ИіCoдзгЁЂ3ИіFдзгЃЌдђОЇАћЕФжЪСПЮЊ![]() ЃЌЙЪОЇЬхУмЖШЮЊ
ЃЌЙЪОЇЬхУмЖШЮЊ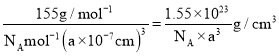 ЃЛ
ЃЛ