题目内容
【题目】甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为______。
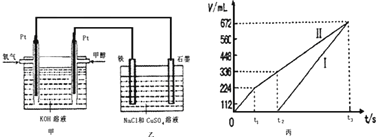
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为_____________mol。
(4)写出甲中通入甲醇这一极的电极反应式______________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为___________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_____________g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____________克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
【答案】CH3OH(l)+3/2 O2(g)== CO2(g)+2H2O(l)ΔH=(2Q1+3Q2+2Q3)kJmol-1 3Cl2+2NH4++8OH-=N2↑+6Cl-+8H2O 5×10-4 CH3OH-6e-+8OH-=CO32-+6H2O 4OH--4e-=O2↑+2H2O 0.1 1.28 0.016
【解析】
(1)依据热化学方程式和盖斯定律计算分析得到所需热化学方程式;
(2)可以根据反应物和生成物正确书写化学方程式;
(3)依据离子方程式的定量关系计算生成硫酸根离子的量;
(4)在燃料电池的中,负极上是燃料发生失电子的氧化反应,根据电解质环境来书写电极反应式;
(5)根据电解池的电极反应规律来书写电解反应,结合电子守恒和离子的量的关系进行计算;
(6)根据n=![]() 计算出氧气的物质的量,再根据丙中图象判断铜离子的总物质的量,最后根据m=nM计算出生成铜的质量;
计算出氧气的物质的量,再根据丙中图象判断铜离子的总物质的量,最后根据m=nM计算出生成铜的质量;
(7)根据Q=It和N=Q/e-结合CH3OH-6e-+8OH-=CO32-+6H2O计算。
(1)根据盖斯定律,将已知热化学方程式中的氢气和水蒸气消去,得到1mol甲醇完全燃烧生成二氧化碳气体和液态水的热化学方程式是CH3OH(l)+3/2 O2(g)== CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJmol-1;
(2)铵根离子,可在碱性条件下通入氯气,反应生成氮气,可知氯气被还原为Cl-,同时应该有水生成,发生反应的离子方程式为3Cl2+2NH4++8OH-=N2↑+6Cl-+8H2O;
(3)1molS2O32-被氧化为SO42-转移8mol电子,过量的氯气为1×10-3mol,完全被还原转移电子为2×10-3mol,故参加反应的S2O32-为![]() =0.25×10-3mol,生成的SO42-为0.25×10-3mol×2=0.5×10-3mol;
=0.25×10-3mol,生成的SO42-为0.25×10-3mol×2=0.5×10-3mol;
(4)在燃料电池的中,负极上是燃料发生失电子的氧化反应,在碱性环境下,甲醇失电子的过程为:CH3OH-6e-+8OH-=CO32-+6H2O;
(5)石墨为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=![]() ×2=0.02mol,所以c(NaCl)==0.1mol/L;
×2=0.02mol,所以c(NaCl)==0.1mol/L;
(6)标况下的氧气336mL的物质的量为![]() =0.015mol,转移电子数为0.015mol×4=0.06mol;阴极析出铜的物质的量为
=0.015mol,转移电子数为0.015mol×4=0.06mol;阴极析出铜的物质的量为![]() =0.02mol,质量为0.02mol×64g·mol-1=1.28g;
=0.02mol,质量为0.02mol×64g·mol-1=1.28g;
(7)电解装置的电流强度达到5.0A,每分钟转移电子的物质的量为![]() =0.003mol,负极通入气体的质量为
=0.003mol,负极通入气体的质量为![]() ×32g·mol-1=0.016g。
×32g·mol-1=0.016g。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案