题目内容
【题目】![]() 下列物质中,既含有极性共价键,又含有非极性共价键的是______
下列物质中,既含有极性共价键,又含有非极性共价键的是______
A.![]() B.
B.![]() C.
C.![]()
![]()
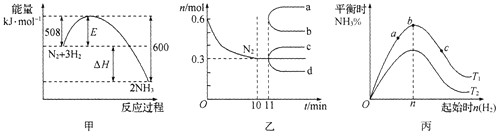
![]() 某离子晶体晶胞的结构如图1所示,
某离子晶体晶胞的结构如图1所示,![]() 位于立方体中心,
位于立方体中心,![]() 位于立方体顶点。该晶体的化学式为______
位于立方体顶点。该晶体的化学式为______
A.![]()
![]() C.
C.![]()
![]()
![]() 下列物质性质的变化规律与键能无关的是______
下列物质性质的变化规律与键能无关的是______
A.热稳性:![]()
B.熔、沸点:金刚石![]() 晶体硅
晶体硅
C.熔点:![]()
D.熔、沸点:![]()
![]() 、S、Se是同一主族元素,请回答下列问题:
、S、Se是同一主族元素,请回答下列问题:
![]() 、S、Se的电负性由大到小的顺序是______。
、S、Se的电负性由大到小的顺序是______。
![]() 是______分子
是______分子![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() ,中心原子的轨道杂化类型为______,
,中心原子的轨道杂化类型为______,![]() 分子的立体构型名称是______。
分子的立体构型名称是______。
![]() 的沸点高于
的沸点高于![]() 的沸点,其原因是______。
的沸点,其原因是______。
![]() 与
与![]() 分子互为等电子体的阴离子为______
分子互为等电子体的阴离子为______![]() 填化学式
填化学式![]() 。
。
![]() 已知Se原子比O原子多2个电子层,基态Se原子核外电子排布式为______,有______个未成对电子。
已知Se原子比O原子多2个电子层,基态Se原子核外电子排布式为______,有______个未成对电子。
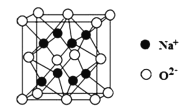
![]() 离化合物
离化合物![]() 的晶胞如图所示,
的晶胞如图所示,![]() 的配位数是______;若阿伏加德罗常数值为
的配位数是______;若阿伏加德罗常数值为![]() ,晶胞参数为anm,列式计算晶体的密度
,晶胞参数为anm,列式计算晶体的密度![]() ______
______![]() 只列式,不用计算最后结果
只列式,不用计算最后结果![]() 。
。
【答案】![]()
![]()
![]()
![]() 极性
极性 ![]() V形
V形 ![]() 分子之间形成氢键,
分子之间形成氢键,![]() 分子之间为范德华力,氢键比范德华力更强
分子之间为范德华力,氢键比范德华力更强 ![]()
![]() 2
2 ![]()
![]()
【解析】
![]() 根据形成化学键的元素性质分析化学键的类型;
根据形成化学键的元素性质分析化学键的类型;
![]() 根据晶胞的结构计算晶胞中原子数目,进而确定化学式;
根据晶胞的结构计算晶胞中原子数目,进而确定化学式;
![]() 根据晶体类型与物质的熔沸点等性质的关系分析解答;
根据晶体类型与物质的熔沸点等性质的关系分析解答;
![]() 根据元素周期律比较电负性;根据分子空间构型分析分子的极性;根据等电子体的概念书写对应的等电子体;根据核外电子排布规律书写核外电子排布式;
根据元素周期律比较电负性;根据分子空间构型分析分子的极性;根据等电子体的概念书写对应的等电子体;根据核外电子排布规律书写核外电子排布式;
![]() 由晶胞结构,用均摊法计算晶胞中Na、O原子数目,计算晶胞质量及密度。
由晶胞结构,用均摊法计算晶胞中Na、O原子数目,计算晶胞质量及密度。
![]() 中C、O原子之间形成极性键;
中C、O原子之间形成极性键;![]() 中碳原子之间形成非极性键,C原子与H原子之间形成极性键;
中碳原子之间形成非极性键,C原子与H原子之间形成极性键;![]() 中O、H原子之间形成极性键;
中O、H原子之间形成极性键;![]() 中氯离子与铵根离子之间形成离子键,铵根离子中N、H原子之间形成极性键,故答案为:B;
中氯离子与铵根离子之间形成离子键,铵根离子中N、H原子之间形成极性键,故答案为:B;
![]() X处于体心,晶胞中X数目为1,Y处于晶胞顶点,晶胞中Y原子数目
X处于体心,晶胞中X数目为1,Y处于晶胞顶点,晶胞中Y原子数目![]() ,故X、Y原子数目之比
,故X、Y原子数目之比![]() :1,故化学式为
:1,故化学式为![]() ,故答案为A;
,故答案为A;
![]() A.键能越大,共价键越稳定,氢化物越稳定,故A不符合;
A.键能越大,共价键越稳定,氢化物越稳定,故A不符合;
B.二者均为原子晶体,键能越大,破坏共价键需要能量越高,熔沸点越高,故B不符合;
C.金属离子晶体,金属键越强,破坏金属键需要能量越高,熔点越高,故C不符合;
D.均属于分子晶体,分子间作用力影响熔沸点,与键能无关,故D符合,
故答案为D;
![]()
![]() 同主族自上而下电负性减小,故电负性:
同主族自上而下电负性减小,故电负性:![]() ,故答案为:
,故答案为:![]() ;
;
![]() O原子形成2个
O原子形成2个![]() 键,还有2对孤电子对,杂化轨道数目为4,O原子杂化方式为
键,还有2对孤电子对,杂化轨道数目为4,O原子杂化方式为![]() ,
,![]() 是V形结构,分子中正负电荷重心不重合,属于极性分子,故答案为:极性;
是V形结构,分子中正负电荷重心不重合,属于极性分子,故答案为:极性;![]() ;V形;
;V形;
![]() H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强,故H2O的沸点高于H2S的沸点,故答案为:H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强;
H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强,故H2O的沸点高于H2S的沸点,故答案为:H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强;
![]() 与H2S分子互为等电子体的阴离子可以用N原子与1个单位负电荷替换O原子,等电子体为:
与H2S分子互为等电子体的阴离子可以用N原子与1个单位负电荷替换O原子,等电子体为:![]() 等,故答案为:
等,故答案为:![]() ;
;
![]() 原子比O原子多2个电子层,处于第四周期VIA族,基态Se原子核外电子排布式为
原子比O原子多2个电子层,处于第四周期VIA族,基态Se原子核外电子排布式为![]() ,4p轨道有2个未成对电子,故答案为:
,4p轨道有2个未成对电子,故答案为:![]() ;2;
;2;
![]() 由晶胞结构,以上底面面心
由晶胞结构,以上底面面心![]() 研究,与之距离相等且最近的
研究,与之距离相等且最近的![]() 为晶胞上层的4个
为晶胞上层的4个![]() 、上一个晶胞下层的4个
、上一个晶胞下层的4个![]() ,即
,即![]() 的配位数是8;晶胞中Na原子数目为8、O原子数目
的配位数是8;晶胞中Na原子数目为8、O原子数目![]() ,晶胞质量
,晶胞质量![]() ,晶体密度
,晶体密度![]()
![]() ,故答案为:8;
,故答案为:8;![]() 。
。