题目内容
11.依据事实,写出下列反应的热化学方程式.(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ•mol-1.
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)
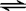 2NH3(g)△H=-92kJ•mol-1
2NH3(g)△H=-92kJ•mol-1(4)已知:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1,
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1,
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1.
请写出CO还原FeO的热化学方程式:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.76KJ,根据燃烧热的概念分析即可解答;
(2)根据热化学方程式的书写方法结合热化学方程式的意义来回答;
(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(4)依据盖斯定律结合热化学方程式计算,然后写出热化学方程式.
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,燃烧热热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;
(2)适量的N2和O2完全反应,每生成0.5NO2需要吸收16.95kJ热量,所以每生成1molNO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ•mol-1;
(3)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:N2(g)+3H2(g) 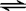 2NH3(g)△H=-92kJ•mol-1;
2NH3(g)△H=-92kJ•mol-1;
(4)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol
依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66KJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol,
故答案为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

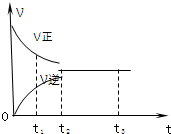 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应不再发生 | D. | t2-t3,各物质的浓度还在发生变化 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
| A. | SO2和H2S | B. | O2和NH3 | C. | CO2和H2 | D. | CH4和O2 |
| A. | C2H6 | B. | C4H8 | C. | C3H8 | D. | C3H6 |
| A. | 1molP4含有p-p键的个数为4NA | |
| B. | 1molSiC中含有C-Si键的个数为2NA | |
| C. | 含C为1mol的金刚石中含有C-C键的个数为2NA | |
| D. | 1molSi02中含Si-O键的个数为2NA |
| A. | a=b+m-n | B. | a=b-m+n | C. | a-m=b+n | D. | a-m=b-n |
| A. | ns2 | B. | ns2np1 | C. | ns2np4 | D. | ns2np5 |
| A. | 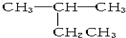 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. |  间二甲苯 间二甲苯 | D. | 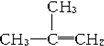 2-甲基-2-丙烯 2-甲基-2-丙烯 |