题目内容
19.实验室制取下列各组气体时,发生装置和收集方法相同,且都能用浓硫酸干燥的是( )| A. | SO2和H2S | B. | O2和NH3 | C. | CO2和H2 | D. | CH4和O2 |
分析 浓硫酸具有吸水性,可用来干燥气体,能与硫酸反应的气体不能利用浓硫酸干燥,如氨气;浓硫酸一般能干燥中性和酸性气体,选择气体的发生装置考虑制取气体的反应物状态和反应条件,可分为固体加热型、固液常温型、固固加热型等,以此来解答.
解答 解:A.因浓硫酸具有强氧化性,能氧化H2S,不能利用浓硫酸干燥,故A错误;
B.浓硫酸具有酸性,能与NH3反应,不能利用浓硫酸干燥,故B错误;
C.CO2和H2都是固液常温型装置,二氧化碳用向下排空气法收集,氢气用向上排空气法收集,收集方法不同,故C错误;
D.甲烷可用无水醋酸钠和碱石灰强热而制得,氧气可用氯酸钾和二氧化锰加热制取,CH4和O2都是固固加热型装置,都可用排水法收集,都能用浓硫酸干燥,故D正确.
故选D.
点评 本题考查气体发生装置和收集装置和浓硫酸的吸水性及作干燥剂,明确浓硫酸与被干燥的气体发生化学反应是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.某实验小组做乙醛和新制氢氧化铜的反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5mL 40%的乙醛溶液进行下列实验.
(1)上表中a、b应为B(填字母序号).
A.15滴,1mL B.2mL,1mL
C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀.该反应的化学方程式为CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
A.15滴,1mL B.2mL,1mL
C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀.该反应的化学方程式为CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
7.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A. | 海水中含有溴元素,只需经过化学变化就可以得到高纯度的溴 | |
| B. | 海水淡化涉及到了化学变化 | |
| C. | 从海水中可以得到NaCl,除了食用外,还可以用于工业制氯气 | |
| D. | 海水中含有丰富的钠、镁、碘、金 |
14.除去下列物质中含有的少量杂质,请选择合适的所给试剂、操作方法填入下表中(只填序号)
试剂:A.溴水 B.NaOH溶液 C.CaO D.酸性KMnO4 溶液 E.饱和Na2CO3溶液
操作方法:a.蒸馏 b.分液 c.洗气 d.过滤 e.干馏 f.分馏 g.裂化
试剂:A.溴水 B.NaOH溶液 C.CaO D.酸性KMnO4 溶液 E.饱和Na2CO3溶液
操作方法:a.蒸馏 b.分液 c.洗气 d.过滤 e.干馏 f.分馏 g.裂化
| 组别 | 物质 | 杂质 | 试剂 | 操作方法 |
| 1 | 乙烷 | 乙烯 | ||
| 2 | 溴苯 | 溴 | ||
| 3 | 乙酸乙酯 | 乙酸 | ||
| 4 | 乙醇 | 水 | ||
| 5 | 将重油转化为汽油 | |||
| 6 | 把煤转化为焦炉气、煤焦油和焦炭等 | |||
4.通式为CnH2n+1OH(n≠1)的醇不能发生消去反应,n的最小值是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
3.相距很远的两个氢原子相互逐渐靠近,在这一过程中体系能量将( )
| A. | 逐渐变小 | B. | 逐渐增大 | C. | 先变大,后变小 | D. | 先变小,后变大 |

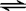 2NH3(g)△H=-92kJ•mol-1
2NH3(g)△H=-92kJ•mol-1