题目内容
1.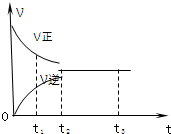 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应不再发生 | D. | t2-t3,各物质的浓度还在发生变化 |
分析 由图可知,反应从正反应开始,在t2之前正反应速率大于逆反应速率,t2时反应到达限度,在t2之后化学反应处于动态平衡中,各物质的浓度不再变化.
解答 解:A、t1时,正逆反应都发生,且正方向反应速率大于逆反应速率,故A错误;
B、t2时,正逆反应速率相等,则反应到达限度,故B正确;
C、t2-t3,正逆反应速率相等,化学反应达到动态平衡,故C错误;
D、t2-t3,为化学平衡状态,各物质的浓度不再发生变化,故D错误;
故选B.
点评 本题考查化学反应速率及化学平衡图象,注重对图象的分析,明确图象中纵横坐标及点、线、面的意义是解答本题的关键,难度不大.

练习册系列答案
相关题目
11.已知在碱存在下,卤代烃与醇反应生成醚(R-O-R′):R-X+R′OH$\stackrel{KOH/高温}{→}$R-O-R′+HX,则BrCH2CH2CH2OH可发生的反应有:①氧化反应;②还原反应;③加成反应;④在强酸强碱条件下均可发生消去反应;⑤可发生聚合反应生成高分子化合物,
其中正确的组合是( )
其中正确的组合是( )
| A. | ①②③ | B. | ①④ | C. | ①④⑤ | D. | ②③④ |
12.下列物质中,既有离子键,又有非极性共价键的是( )
| A. | H2SO4 | B. | CaCl2 | C. | NH4Cl | D. | Na2O2 |
16. 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
(1)滴定管如图所示,用乙滴定管盛装0.2500mol/L氢氧化钠标准液 (填“甲”或“乙”).根据所给数据,该盐酸溶液的浓度为0.2632 mol/L
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选酚酞作指示剂,判断滴定终点的现象是滴入最后一滴标准液,溶液由无色变成浅红色,且半分钟内不恢复原来的颜色
(3)下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:| 实验编号 | 待测液体积/mL | 所消耗氢氧化钠标准液的体积/mL |
| 1 | 25.00 | 26.30 |
| 2 | 25.00 | 26.34 |
| 3 | 25.00 | 19.36 |
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选酚酞作指示剂,判断滴定终点的现象是滴入最后一滴标准液,溶液由无色变成浅红色,且半分钟内不恢复原来的颜色
(3)下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
13.下列说法中,不正确的是( )
| A. | 硫既可做氧化剂,又可做还原剂 | B. | SO3只有氧化性 | ||
| C. | 可以用铁罐贮运冷的浓H2SO4 | D. | H2S既有氧化性又有还原性 |
10.某实验小组做乙醛和新制氢氧化铜的反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5mL 40%的乙醛溶液进行下列实验.
(1)上表中a、b应为B(填字母序号).
A.15滴,1mL B.2mL,1mL
C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀.该反应的化学方程式为CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
A.15滴,1mL B.2mL,1mL
C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀.该反应的化学方程式为CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.

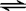 2NH3(g)△H=-92kJ•mol-1
2NH3(g)△H=-92kJ•mol-1