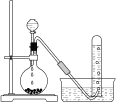
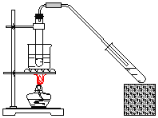
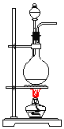
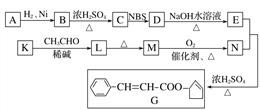
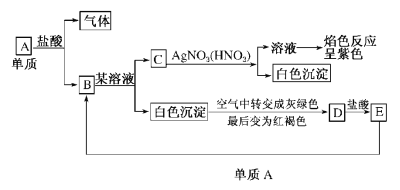
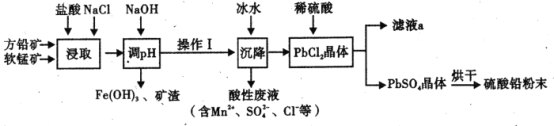
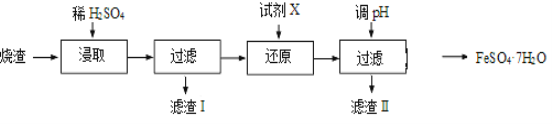
题目内容
【题目】铝土矿的主要成分是A12O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取A12O3。

回答下列问题:
(1)沉淀物的化学式分别是:
![]() __________;d__________; f__________;
__________;d__________; f__________;
(2)写出加入过量NaOH溶液时所发生主要反应的离子方程式____________、________
(3)写出通入气体B(过量)时溶液C中发生反应的离子方程式___________、____________。
(4)气体B能否改用试剂A代替?为什么?_________,_________________。
【答案】SiO2 Fe(OH)3 Al(OH)3 Al3++4OH-═AlO2-+2H2O Fe3++3OH-═Fe(OH)3↓ CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- CO2+OH-═HCO3- 不能 生成氢氧化铝能够溶于盐酸
【解析】
SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,沉淀a为二氧化硅,b溶液加入过量氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液c中,气体B为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝;
(1)根据以上推断写出沉淀的化学式;
(2)过量氢氧化钠溶液与铁离子、铝离子反应;
(3)滤液c中含有偏铝酸根离子和过量的氢氧化钠,二氧化碳与偏铝酸根离子生成氢氧化铝沉淀、与氢氧根离子反应生成碳酸氢根离子;
(4)试剂A为盐酸,气体B为二氧化碳,不能够用盐酸代替二氧化碳,根据氢氧化铝能够溶解于盐酸分析。
SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,沉淀a为二氧化硅,b溶液加入过量氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液c中,气体B为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝;
(1)根据分析可知,沉淀a为SiO2,沉淀d为Fe(OH)3,沉淀f为Al(OH)3;
(2)滤液b中含有铁离子和铝离子,加入氢氧化钠溶液反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,Fe3++3OH-═Fe(OH)3↓;
(3)根据流程,滤液c中含有过量的氢氧化钠和偏铝酸根离子,溶液NaAlO2与过量CO2生成Al(OH)3沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,过量二氧化碳与氢氧根离子反应生成碳酸氢根离子,反应的离子方程式为:CO2+OH-═HCO3-;
(4)气体B为二氧化碳,试剂A为盐酸,氢氧化铝能够与过量的盐酸反应而溶解,无法控制加入盐酸的量。

【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。部分化学键的键能如下表:
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/kJmol-1 | 946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO) (丙容器/span>)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率υ(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
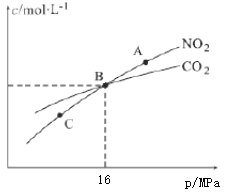
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。