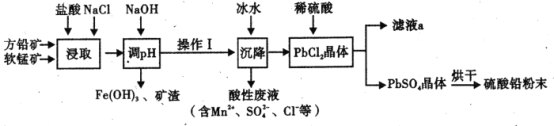
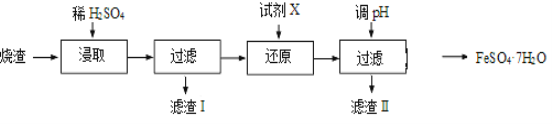
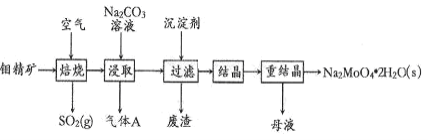
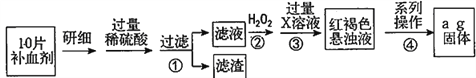
题目内容
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示
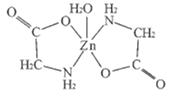
(1)基态Zn2+核外价电子排布图为_____;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的排列顺序为_____。
(2)甘氨酸(H2N-CH2-COOH)的羧基中C原子的杂化轨道类型为_____;甘氨酸易溶于水,试从结构角度解释:_____。
(3)以氧化锌矿物为原料,提取锌的过程中涉及反应:Zn+2NH3+ 2NH4+= [Zn(NH3)4]2++H2O。与NH4+互为等电子体的阴离子为_____(写岀1种即可);[Zn(NH3)4]2+ 离子结构示意图:____________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1mol IMI中含有_____个σ键;常温下IMI的某种衍生物与甘氨酸形成的离子化合物
,则1mol IMI中含有_____个σ键;常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态,其原因是_____。
为液态而非固态,其原因是_____。
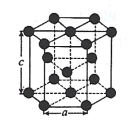
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为 _____;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则Zn的密度为_____gcm-3(列出算式即可)。
【答案】![]() O>N>C>H sp2 甘氨酸为极性分子,且分子中的氨基和羧基都能与水分子形成氢键 BH4-或AlH4-
O>N>C>H sp2 甘氨酸为极性分子,且分子中的氨基和羧基都能与水分子形成氢键 BH4-或AlH4- 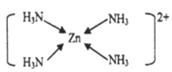 7.22×1024 该化合物中阴、阳离子的体积大,且所带电荷少,从而形成的离子晶体晶格能小,熔点低 六方最密堆积
7.22×1024 该化合物中阴、阳离子的体积大,且所带电荷少,从而形成的离子晶体晶格能小,熔点低 六方最密堆积 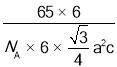
【解析】
(1)基态Zn2+的价电子为其3d能级上的10个电子;一水合甘氨酸锌中所涉及的非金属元素有C、O、N、H元素,元素的非金属性越强,其电负性越大;
(2)甘氨酸(H2N-CH2-COOH)中亚甲基上C原子和N原子价层电子对个数都是4、羧基上的C原子价层电子对个数是3,根据价层电子对互斥理论判断C、N原子的杂化轨道类型;甘氨酸为极性分子,且氨基和羧基都能和水分子形成分子间氢键;
(3)等电子体是含有原子数目相同,价电子总数相等的微粒;
(4)1个IMI中含有12个σ键;离子晶体的晶格能影响其熔沸点,其晶格能越小熔沸点越低;
(5)金属锌的这种堆积方式称为六方最密堆积,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=![]() 。
。
(1)基态Zn2+的价电子为其3d能级上的10个电子,其价电子排布图为![]() ;一水合甘氨酸锌中所涉及的非金属元素有C.O、N、H元素,元素的非金属性越强,其电负性越大,非金属性大小顺序为O>N>C>H,则电负性大小顺序为O>N>C>H,
;一水合甘氨酸锌中所涉及的非金属元素有C.O、N、H元素,元素的非金属性越强,其电负性越大,非金属性大小顺序为O>N>C>H,则电负性大小顺序为O>N>C>H,
故答案为:![]() ;O>N>C>H;
;O>N>C>H;
(2)甘氨酸(H2NCH2COOH)中亚甲基上C原子和N原子价层电子对个数都是4、羧基上的C原子价层电子对个数是3,根据价层电子对互斥理论,亚甲基上碳原子和N原子采用sp3杂化、羧基上的C原子采用sp2杂化;甘氨酸为极性分子,且氨基和羧基都能和水分子形成分子间氢键,导致甘氨酸易溶于水,
故答案为:sp2;甘氨酸为极性分子,且氨基和羧基都能和水分子形成分子间氢键;
(3) 根据等电子体原理,与NH4+互为等电子体的阴离子为BH4-或AlH4-,[Zn(NH3)4]2+ 离子结构示意图:
故答案为:BH4-或AlH4-; ;
;
(4)1个IMI中含有12个σ键,则IMI中含有12NA个σ键,即是7.22×1024;离子晶体的晶格能影响其熔沸点,其晶格能越小熔沸点越低,该化合物中阴、阳离子的体积大,且所带电荷少,从而形成的离子晶体晶格能小,熔点低,
故答案为:7.22×1024;该化合物中阴、阳离子的体积大,且所带电荷少,从而形成的离子晶体晶格能小,熔点低;
(5)金属锌的这种堆积方式称为六方最密堆积,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3=a2c×
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3=a2c×![]() ,晶胞的质量span>m=
,晶胞的质量span>m=![]() ,晶胞密度=
,晶胞密度=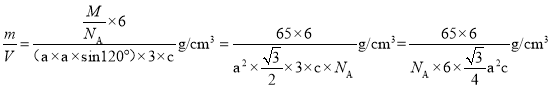 ,故答案为:六方最密堆积;
,故答案为:六方最密堆积; 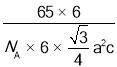 。
。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案