题目内容
6.能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定.这种溶液称为缓冲溶液.例如:人体血液中HCO3-和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05.某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液.已知该缓冲溶液利用的平衡体系是:H2PO4-?H++HPO42-,请根据该平衡体系分析其缓冲原理:加酸性物质时,平衡逆向移动,氢离子浓度略微减小;加碱性物质时,平衡正向移动,氢离子浓度略微增大,溶液pH变化不明显.分析 能够形成缓冲溶液,必须是可逆反应,存在化学平衡,外加氢离子或氢氧根离子时,溶液的pH没有明显变化,据此分析.
解答 解:NaH2PO4溶液和Na2HPO4溶液混合后,溶液中存在,H2PO4-?H++HPO42-,加酸性物质时,平衡逆向移动,氢离子浓度略微减小;加碱性物质时,平衡正向移动,氢离子浓度略微增大,溶液pH变化不明显,
故答案为:加酸性物质时,平衡逆向移动,氢离子浓度略微减小;加碱性物质时,平衡正向移动,氢离子浓度略微增大,溶液pH变化不明显.
点评 本题考查了缓冲溶液的相关知识,考查比较基础,注意能够形成缓冲溶液,必须是可逆反应,存在化学平衡.

练习册系列答案
相关题目
17.如图是草酸溶液中H2C2O4、HC2O4-三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量被度和的比值)与pH的关系图,下到有关说法不正确的是( )
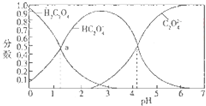

| A. | pH=5的溶液中c(C2O42-)>c(HC2O4-) | |
| B. | NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| C. | 向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中2c(Na+)=c(HC2O4-)+c(H2C2O4) | |
| D. | 为使溶液中c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右 |
14.对于钠的卤化物(NaX)和硅的卤化物分子(SiX4),下列叙述正确的是( )
| A. | SiX4呈空间网状结构,硬度大 | |
| B. | NaX的熔点一般高于SiX4 | |
| C. | NaX易水解 | |
| D. | SiX4由原子构成,熔化时破坏共价键 |
18.氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响.铵盐在工农业生产、生活中有着重大作用.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
则该反应的平衡常数K1>K2(填“>”、“<”或“=”).
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
| T/K | 298 | 398 | 498 | … |
| 平衡常数K | 4.1×106 | K1 | K2 | … |
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
15.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 乙醇与浓硫酸混合,加热至170°C制乙烯的反应属于取代反应 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
16.下列有关粒子组的评价及相关离子方程式均正确的是( )
| 选项 | 粒子组 | 评价及离子方程式 |
| A | K+、Al3+、SO42-、NO3- | 能大量共存于同一溶液中 |
| B | H+、CH3CHO、SO42-、MnO4- | 能大量共存于同一溶液中 |
| C | NH4+、Fe3+、SCN-、Cl- | 不能大量共存,Fe3++3SCN-=Fe(SCN)3↓ |
| D | Na+、K+、HCO3-、OH- | 不能大量共存,HCO3-+OH-=H2O+CO2↑ |
| A. | A | B. | B | C. | C | D. | D |
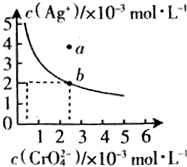 水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.
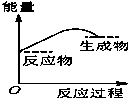
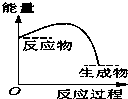
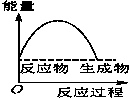
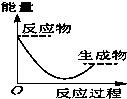
水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD. 将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )