题目内容
3.下列各组离子在水溶液能大量共存的是( )| A. | Cu2+、K+、OH-、SO42- | B. | Na+、Ca2+、HCO3-、Cl- | ||
| C. | NH4+、Al3+、AlO2-、H+ | D. | SO32-、Ba2+、H+、NO3- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生相互促进水解反应、不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.Cu2+、OH-结合生成沉淀,不能共存,故A错误;
B.该组离子之间不反应,可大量共存,故B正确;
C.Al3+、AlO2-相互促进水解,AlO2-、H+结合生成沉淀,不能共存,故C错误;
D.SO32-、Ba2+结合生成沉淀,SO32-、H+、NO3-发生氧化还原反应,不能共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、水解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
13.下列有关实验操作对应的现象及对现象的解释或所得出的结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp(Mg(OH)2)>Ksp(Cu(OH)2) |
| B | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未水解 |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中不含K+ |
| D | 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 | 变浑浊 | 说明该盐是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
14.对于钠的卤化物(NaX)和硅的卤化物分子(SiX4),下列叙述正确的是( )
| A. | SiX4呈空间网状结构,硬度大 | |
| B. | NaX的熔点一般高于SiX4 | |
| C. | NaX易水解 | |
| D. | SiX4由原子构成,熔化时破坏共价键 |
18.氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响.铵盐在工农业生产、生活中有着重大作用.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
则该反应的平衡常数K1>K2(填“>”、“<”或“=”).
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
| T/K | 298 | 398 | 498 | … |
| 平衡常数K | 4.1×106 | K1 | K2 | … |
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
8.下列各组离子在溶液中能大量共存的是( )
| A. | K+、OH-、Na+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
15.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 乙醇与浓硫酸混合,加热至170°C制乙烯的反应属于取代反应 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
13.化学与社会、生活密切相关,下列说法正确的是( )
| A. | 加碘食盐中添加的是碘化钾 | |
| B. | 味觉上具有酸味的食物就是酸性食物 | |
| C. | Fe3O4俗称铁红,常做红色油漆和涂料 | |
| D. | 晶体硅具有半导体性质,可用于生产计算机芯片 |
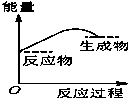
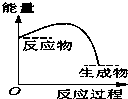
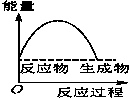
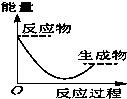
 将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )