题目内容
10.80℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )| A. | pH=3的碳酸中:c(H+)=3.0mol•L-1 | |
| B. | 饱和乙酸钠溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH为2的盐酸中:c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=13的烧碱溶液中:c(OH-)=1.0×10-1mol•L-1 |
分析 A.pH=-lgc(H+),pH=3的碳酸中:c(H+)=0.001mol•L-1;
B.乙酸钠为强碱弱酸盐,乙酸根离子水解,溶液显示碱性结合电荷守恒分析解答;
C.氯化氢为强电解质,完全电离,溶液中存在氯离子、氢离子、氢氧根离子,根据电荷守恒分析解答;
D.常温下,Kw=c(H+)×c(OH-)═1×10-14,水的电离吸热,80℃时,Kw=c(H+)×c(OH-)>1×10-14,PH=-lgc(H+),据此分析解答.
解答 解:A.根据pH=-lgc(H+)可知,pH=3的碳酸中:c(H+)=0.001mol•L-1,故A错误;
B.CH3COONa,由化学式可知,阴阳离子之比为1:1,根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),醋酸根离子水解显碱性,c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),故B错误;
C.氯化氢为强电解质,溶液中存在氯离子、氢离子、氢氧根离子,任何溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(Cl-)+c(OH-),故C正确;
D.PH=-lgc(H+),pH=13的烧碱溶液中:c(H+)=1×10-13mol•L-1,水的电离吸热,80℃时,Kw=c(H+)×c(OH-)>1×10-14,所以c(OH-)>1.0×10-1mol•L-1,故D错误;
故选C.
点评 本题考查了溶液pH的简单计算,题目难度不大,注意掌握pH=-lgc(H+)的计算方法及温度对Kw的影响,选项D为易错点,注意水的电离吸热,80℃时,Kw=c(H+)×c(OH-)>1×10-14.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
20.逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是( )
| A. | 有机物一定含有碳元素,所以含碳元素的化合物一定是有机物 | |
| B. | 置换反应中有单质生成,所以有单质生成的反应一定属于置换反应 | |
| C. | 含碳元素的物质在O2中充分燃烧会生成CO2,所以在O2中燃烧能生成CO2的物质一定含碳元素 | |
| D. | 盐的组成中含有金属阳离子与酸根离子,所以盐中一定不含氢元素 |
18.氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响.铵盐在工农业生产、生活中有着重大作用.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
则该反应的平衡常数K1>K2(填“>”、“<”或“=”).
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
| T/K | 298 | 398 | 498 | … |
| 平衡常数K | 4.1×106 | K1 | K2 | … |
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
5.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 标准状况下,22.4 L乙烯和丙烯混合气体中所含的分子数目为2nA | |
| C. | 1mol Cl2与足量Fe粉反应生成FeCl3,转移2nA个电子 | |
| D. | 1L 0.1 mol•L-1 Na2S溶液中含有0.1nA个S2- |
15.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 乙醇与浓硫酸混合,加热至170°C制乙烯的反应属于取代反应 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
2.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨).下列说法不正确的是( )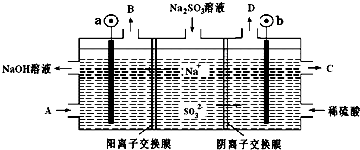

| A. | b电极上的主反应是 SO32--2e-+H2O═SO42-+2H+ | |
| B. | 若D是混合气体,则可能含有SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 | |
| D. | A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
19.下列说法不正确的是( )
| A. | 发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染 | |
| B. | 物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 | |
| C. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 | |
| D. | 农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
20.下列气态氢化物中最稳定的是( )
| A. | PH3 | B. | NH3 | C. | H2O | D. | CH4 |