题目内容
13.天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11).该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如图所示(注意图中的反应式不完整).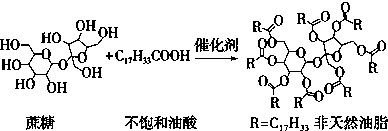
下列说法正确的是( )
| A. | 蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质 | |
| B. | 该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应 | |
| C. | 非天然油脂为高分子化合物 | |
| D. | 该蔗糖酯在稀硫酸的作用下水解,最终可生成多种有机分子 |
分析 A.油脂为高级脂肪酸甘油酯;
B.该非天然油脂与NaOH共热,其水解产物含有不饱和油酸盐;
C.高分子化合物的相对分子质量在10000以上;
D.该蔗糖酯在稀硫酸的作用下水解生成蔗糖和不饱和油酸.
解答 解:A.油脂为高级脂肪酸甘油酯,蔗糖不是甘油,则该物质不属于油脂,故A错误;
B.水解生成不饱和油酸盐,含双键,水解产物与溴水反应,故B错误;
C.高分子化合物的相对分子质量在10000以上,而非天然油脂相对分子质量在10000以下,不属于高分子化合物,故C错误;
D.该蔗糖酯在稀硫酸的作用下水解生成蔗糖和不饱和油酸,则生成两种有机物,蔗糖能水解生成葡萄糖和果糖,则最终生成三种有机物,故D正确;
故选D.
点评 本题以信息的形式考查有机物的结构与性质,为高频考点,明确结构决定性质是解答本题的关键,并熟悉油脂、糖类物质的性质及高分子化合物的概念来解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.X、Y、Z为短周期元素,X的单质与水在常温条件下就能剧烈反应生成一种还原性气体,Y的最高价氧化物对应的水化物是一种酸性最强的酸;Z与Y同周期且只能形成ZY3;X、Z的简单离子核外电子排布相同.下列有关叙述正确的是( )
| A. | 离子半径:X>Y>Z | B. | 最外层电子数:Y>Z>X | ||
| C. | 原子序数:Z>Y>X | D. | 单质熔点:X>Z>Y |
4.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | X和Y两元素一定不在同一周期 | |
| C. | 元素Z、W的简单离子的电子层结构相同 | |
| D. | X、W两元素一定能形成两种组成不同的氧化物 |
8.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温常压下,2.8gN2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
18.氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响.铵盐在工农业生产、生活中有着重大作用.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
则该反应的平衡常数K1>K2(填“>”、“<”或“=”).
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
完成下列填空
(1)在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)$?_{加热}^{催化剂}$2NH3(g),其平
衡常数K与温度T的关系如下表.
| T/K | 298 | 398 | 498 | … |
| 平衡常数K | 4.1×106 | K1 | K2 | … |
(2)能说明该反应已达到平衡状态的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变.
5.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 标准状况下,22.4 L乙烯和丙烯混合气体中所含的分子数目为2nA | |
| C. | 1mol Cl2与足量Fe粉反应生成FeCl3,转移2nA个电子 | |
| D. | 1L 0.1 mol•L-1 Na2S溶液中含有0.1nA个S2- |
2.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨).下列说法不正确的是( )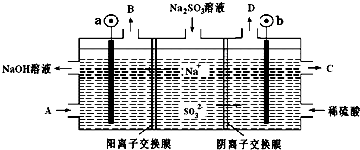

| A. | b电极上的主反应是 SO32--2e-+H2O═SO42-+2H+ | |
| B. | 若D是混合气体,则可能含有SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 | |
| D. | A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
3.NA表示阿伙加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,17g氨气分子所含质子数为10NA | |
| B. | 1mol CL2参加反应,转移电子数一定为2N | |
| C. | 常温常压下,22.4 L C02分子中含有2NA个σ键和2NA个1π键 | |
| D. | 1 L 0.01 mol.L-1的Na2CO3溶液中含有0.01NA个CO2- |