题目内容
4.生活中处处有化学,下列说法不正确的是( )| A. | 采用原煤脱硫技术,可减少燃煤时产生的SO2 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |
分析 A、燃煤燃烧可导致二氧化硫、粉尘等对空气的污染;
B.防腐剂是指保持食品原有的质量和食品营养价值为目的食品添加剂,它能抑制微生物的生长和繁殖,防止食品腐败变质而延长保质期;
C.可回收垃圾就是可以再生循环的垃圾.本身或材质可再利用的纸类、硬纸板、玻璃、塑料、金属、人造合成材料;
D.氧化还原反应的特征是元素化合价的升降,与发生氧化还原反应,应存在元素化合价的变化.
解答 解:A、燃煤燃烧可导致二氧化硫、粉尘等对空气的污染,所以采用原煤脱硫技术,可减少燃煤产生的SO2,故A正确;
B.防腐剂能保持食品原有的质量和食品营养价值,适量添加防腐剂,可以保障安全,故B正确;
C.废旧电池属于不可回收垃圾,故C错误;
D.葡萄糖在酒曲酶的作用下可生成乙醇属于氧化还原反应,故D正确.
故选C.
点评 本题考查较为综合,煤的脱硫、防腐剂、可回收垃圾、淀粉的性质和用途,为高考常见题型,侧重于基础知识的考查,有利于培养学生的良好的科学素养和提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
14.如图是产生和收集气体的实验装置,该装置最适合( )
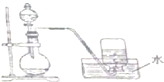

| A. | 氯酸钾和二氧化锰的混合物制取氧气 | |
| B. | 石灰石和盐酸制取二氧化碳 | |
| C. | 浓盐酸和二氧化锰制取氯气 | |
| D. | 铜与稀硝酸反应制取一氧化氮 |
15.对下列物质用途的解释中,错误的是( )
| 选项 | 用途 | 解释 |
| A | 硅胶可作袋装食品的干燥剂 | 硅胶多孔,吸收空气中氧气的能力强 |
| B | CuSO4可作游泳池的消毒剂 | 铜盐能使构成病毒的蛋白质变性 |
| C | 浸有高锰酸钾溶液的硅藻土可作某些水果的保鲜剂 | 高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| D | Na2O2可作呼吸面具中的供氧剂 | Na2O2能吸收CO2同时放出O2 |
| A. | A | B. | B | C. | C | D. | D |
12.有BaCl2和NaCl的混合溶液aL,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗xmol H2SO4、ymol AgNO3.据此得知原混合溶液中的c(Na+)为( )
| A. | $\frac{y-2x}{a}$ mol/L | B. | $\frac{y-x}{a}$ mol/L | C. | $\frac{2y-2x}{a}$ mol/L | D. | $\frac{2y-4x}{a}$mol/L |
13.与氢硫酸反应有沉淀生成的电解质是( )
| A. | 硫酸铜 | B. | 氢氧化钠 | C. | 硫酸亚铁 | D. | 二氧化硫 |
13.丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )
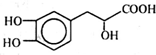

| A. | 丹参素的分子式为C9H10O5 | |
| B. | 1 mol丹参素最多可以和4 mol H2发生加成反应 | |
| C. | 1 mol丹参素在一定条件下与足量金属钠反应可生成2 mol H2 | |
| D. | 丹参素能发生取代、中和、氧化反应等反应 |
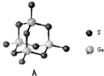 某化合物由阳离子[(CH3)4 N]+和阴离子A按个数比4:1组成,阴离子A的结构如图所示:
某化合物由阳离子[(CH3)4 N]+和阴离子A按个数比4:1组成,阴离子A的结构如图所示: