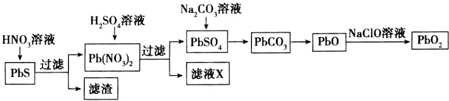
题目内容
14.如图是产生和收集气体的实验装置,该装置最适合( )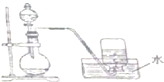
| A. | 氯酸钾和二氧化锰的混合物制取氧气 | |
| B. | 石灰石和盐酸制取二氧化碳 | |
| C. | 浓盐酸和二氧化锰制取氯气 | |
| D. | 铜与稀硝酸反应制取一氧化氮 |
分析 由图可知,为固体与液体反应且不需要加热的反应原理,生成的气体可利用排水法收集,则气体不溶于水,以此来解答.
解答 解:A.氯酸钾和二氧化锰的混合物制取氧气应在加热条件下才能反应,故A错误;
B.二氧化碳微溶于水,不能用排水法收集,故B错误;
C.浓盐酸和二氧化锰制取氯气应在加热条件下才能反应,故C错误;
D.铜与稀硝酸在常温下反应生成一氧化氮,一氧化氮不溶于水,可用于排水法收集,故D正确.
故选D.
点评 本题考查实验装置的综合,为高频考点,把握装置的作用及反应原理为解答的关键,侧重分析能力及实验能力的综合考查,注意常见气体的制备原理,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4. 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |
2.只用一种试剂可区别硫酸钠,硫酸镁,氯化铝,氯化铵四种溶液,这种试剂是( )
| A. | 盐酸 | B. | 氢氧化钠 | C. | 氯化钡 | D. | 硝酸银 |
9.下列关于甲烷,乙烯,乙醇,乙酸的说法中,不正确的是( )
| A. | 乙烯可以使溴水褪色,发生加成反应 | |
| B. | 甲烷和氯气在光照条件下反应,反应类型为取代反应 | |
| C. | 乙醇在铜作催化剂并加热条件下生成乙醛,发生还原反应 | |
| D. | 生活中可以用食醋出去水壶中的水垢,主要是利用食醋中醋酸的酸性 |
19.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
3.环境保护是现代的世界性课题,人类已在多方面取得了突破性进展.
(1)连续自动监测氮氧化物(NOx)的仪器--动态库仑仪已获得实际应用.它的工作原理如下图一所示.NiO电极上NO发生的电极反应式为NO+O2--2e-=NO2.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$.(用△H1和△H2表示)
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
①在NO2与CH4反应时,可提高NO2转化率的措施有CEF.(填编号)
A.增加催化剂的表面积B.改用高效催化剂 C.降低温度
D.增大压强E.分离出H2O(g) F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数.(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图.
(4)SNCR是一种新型的烟气脱氮环保技术.在有氧条件下,其脱氮原理是:NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1.NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示.图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条):脱氮反应是放热反应,达到平衡后升高温度,平衡逆向移动;温度升高发生了副反应:4NH3+5O2═4NO+6H2O.
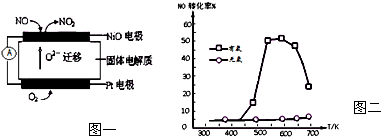
(1)连续自动监测氮氧化物(NOx)的仪器--动态库仑仪已获得实际应用.它的工作原理如下图一所示.NiO电极上NO发生的电极反应式为NO+O2--2e-=NO2.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$.(用△H1和△H2表示)
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
A.增加催化剂的表面积B.改用高效催化剂 C.降低温度
D.增大压强E.分离出H2O(g) F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数.(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图.
(4)SNCR是一种新型的烟气脱氮环保技术.在有氧条件下,其脱氮原理是:NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1.NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示.图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条):脱氮反应是放热反应,达到平衡后升高温度,平衡逆向移动;温度升高发生了副反应:4NH3+5O2═4NO+6H2O.

4.生活中处处有化学,下列说法不正确的是( )
| A. | 采用原煤脱硫技术,可减少燃煤时产生的SO2 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |

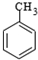 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$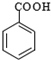
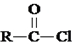
 .
.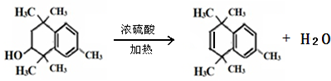 .
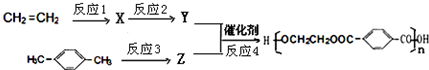
.
 .
.