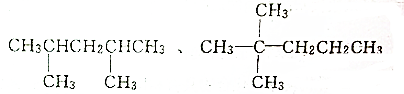题目内容
9.某种赤铁矿样品中含Fe2O3 80%,SiO2 8%,其他不含铁杂质12%,计算这种铁矿石中铁的质量分数.分析 设该磁铁矿的质量为m,铁元素完全来自氧化铁,根据氧化铁的质量分数计算出氧化铁的质量及铁元素的质量,最后计算出这种铁矿石中铁的质量分数.
解答 解:设该磁铁矿的质量为m,则该磁铁矿中氧化铁的质量为:m80%,含有铁元素的质量为:m80%×$\frac{56×2}{160}$=0.56m,
这种铁矿石中铁的质量分数为:$\frac{0.56m}{m}$×100%=56%,
答:这种铁矿石中铁的质量分数为56%.
点评 本题考查了混合物的计算,题目难度不大,注意明确质量守恒定律在化学计算中的应用,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
19.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
17.现在实验室中需少量的一氯乙烷,下列制取方法中所得产物含量最高的是( )
| A. | 乙烷与氯气光照反应 | B. | 乙烯与氯气加成反应 | ||
| C. | 乙烯与氢气、氯气混合气体反应 | D. | 乙烯与氯化氢加成反应 |
4.生活中处处有化学,下列说法不正确的是( )
| A. | 采用原煤脱硫技术,可减少燃煤时产生的SO2 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |
1.在新制的CO2中常混有O2、H2S、HCl和水蒸气等四种杂质,可使用(1)浓H2SO4(2)红热的铜丝(3)饱和的碳酸氢钠溶液(4)CuSO4 溶液.逐一除去杂质得到干燥、纯净的CO2,其正确的操作顺序是( )
| A. | (1)(3)(4) | B. | (2)(3)(4)(1) | C. | (4)(1)(3)(2) | D. | (3)(4)(1)(2) |
18.离子方程式2Ca2++3HCO3-+3OH-→2CaCO3↓+CO32-+3H2O可以表示( )
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | NaHCO3与澄清石灰水反应 | ||
| C. | Ca(HCO3)2与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
18.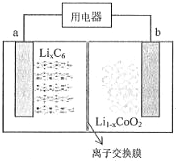 某聚合物锂离子充电电池放电时的反应为:Li1-xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是( )
某聚合物锂离子充电电池放电时的反应为:Li1-xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是( )
 某聚合物锂离子充电电池放电时的反应为:Li1-xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是( )
某聚合物锂离子充电电池放电时的反应为:Li1-xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是( )| A. | 放电时,电子从b极流向a极 | |
| B. | 放电时,a极脱出的离子通过阴离子交换膜从左向右移动 | |
| C. | 充电时,b极发生的反应为:LiCoO2-xe-=Li1-xCoO2+xLi+ | |
| D. | 充电时,每转移x mol 电子,产生6mol碳单质 |