题目内容
16.B、C、Si是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在.
(1)基态硼原子的电子排布式为1s22s22p1.C、N、Si元素原子的第一电离能由大到小的顺序为N>C>Si.
(2)BF3与一定量的水可形成如图1的晶体R.
①晶体R中各种微粒间的作用力涉及abce(填字母).
a、离子键 b、共价键 c、配位键 d、金属键 e、范德华力
②R中阴离子的空间构型为四面体.
(3)乙二胺(H2N-CH2-CH2-NH2)与CaCl2溶液可形成配离子(结构如图2)乙二胺分子中氮原子的杂化类型为sp3杂化.乙二胺和三甲胺[N(CH3)3]均属于铵,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键.
(4)氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.它的晶体结构如图3所示.六方相氮化硼是否含有π键?不含(填“含”或“不含”),其质地软的原因是层与层之间通过范德华力结合在一起;作用力小,导致其质地软,该物质能否导电?不能(填“能”或“不能”),原因是层状结构中没有自由移动的电子.
(5)SiC是原子晶体,其晶胞结构类似金刚石,假设正方体的边长为acm,估算SiC晶体的密度为$\frac{40×4}{{a}^{3}{N}_{A}}$g•cm-3(用含NA、a的代数式表示)
分析 (1)根据构造原理写出硼原子的核外电子排布式;同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(2)晶体R中各种微粒间的作用力涉及离子键、共价键、配位键、范德华力;阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,为四面体构型;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化.
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键.
(4)B位于第2周期ⅢA族,核外电子排布式1s22s22p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形平面三角形,向空间发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;作用力小,导致其质地软,六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,该物质的层状结构中不存在自由移动的电子,所以不导电;
(5)该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞边长=acm,体积V=(acm)3,ρ=$\frac{ρ}{V}$=$\frac{40×4}{{a}^{3}{N}_{A}}$g•cm3.
解答 解:(1)硼原子核外有5个电子,其核外电子排布式为:1s22s22p1,同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、si三种元素的第一电离能由大到小的顺序为:N>C>Si,故答案为:1s22s22p1;N>C>Si;
(2)晶体R中各种微粒间的作用力涉及离子键、共价键、配位键、范德华力;阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,为四面体构型;故答案为:abce;四面体;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化.
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高.
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(4)B位于第2周期ⅢA族,核外电子排布式1s22s22p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形平面三角形,向空间发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;作用力小,导致其质地软,六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,该物质的层状结构中不存在自由移动的电子,所以不导电;
故答案为:不含;层与层之间通过范德华力结合在一起,作用力小,导致其质地软;不能;层状结构中没有自由移动的电子;
(5)该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞边长=acm,体积V=(acm)3,ρ=$\frac{ρ}{V}$=$\frac{40×4}{{a}^{3}{N}_{A}}$g•cm3;
故答案为:$\frac{40×4}{{a}^{3}{N}_{A}}$.
点评 考查核外电子排布规律、电负性、杂化轨道、分子空间结构、氢键与化学键、晶胞等,综合性较大,难度中等,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 核外电子排布由1s22s22p63s1-→1s22s22p6 的变化需要吸收能量 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
| A. | 过氧化钠的电子式: | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}Br$ | |
| C. | 硫离子的结构示意图: | |
| D. | NH3 的电子式: |
| A. | $\frac{a+b}{4}$mol | B. | $\frac{a+c}{4}$mol | C. | $\frac{3a+c}{4}$mol | D. | cmol或$\frac{b}{3}$mol |
①“构造原理”是所有原子随原子序数递增,核外电子排布遵循的规律
②4s轨道的能量一定比3d轨道的能量低
③同一电子层中三个p轨道的能量一定相等
④原子核外电子排布遵循“使整个原子处于能量最低的状态”为总原则.
| A. | ①② | B. | ②③④ | C. | ②④ | D. | ①③ |
| A. | 在蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有吸水性 | |
| B. | 浓硝酸保存在棕色的细口瓶中,并置于低温阴暗处 | |
| C. | 铵盐都不稳定,受热分解都生成氨气 | |
| D. | 向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化 |
| A. | 8个中子的碳原子的核素符号:12C | B. | HF的电子式: | ||
| C. | 氯化镁 | D. | Cl-离子的结构示意图: |
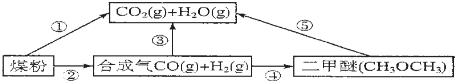
 ,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.
,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.