题目内容
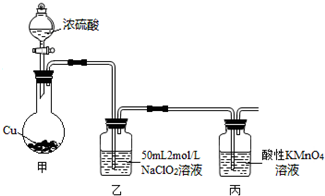
11.硫、碳、氮等元素及其化合物与人类的生产生活密切相关,其中.硫酸、氨气、硝酸都是重要的化工原料.而SO2、NO、NO2、CO等相应氧化物又是主要的环境污染物:(1)过度排放CO2会造成“温室效应”,而煤的气化是高效、清洁利用煤炭的重要途径.煤综合利用的一种途径如图所示.
已知:C(s)+H2O(g)=CO(g)+H2(g) AH1=+131.3kJ•mol-
C(s)十2H20(g)=C02(g)+2H2(g) AH2=+90kJ•mol-
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ•mol-1.
(2)298K时.将氨气放入体积固定的密闭容器中使其发生分解反应.当反应达到平衡状态后.改变其中一个条件X.Y随X的变化符合图中曲线的是ab(填字号):
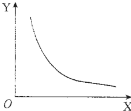
a.当X表示温度时,Y表示氨气的物质的量
b.当X表示压强时.Y表示氨气的转化率
c.当X表示反应时间时.Y表示混合气体的密度
d.当x表示氨气的物质的量时.Y表示某一生成物的物质的量
(3)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染.必须经脱除达标后才能排放:能作脱除剂的物质很多.下列说法正确的是ab(填序号):
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
d.用尿素[CO(NH2)2]作脱除剂.在一定条件下能有效将NOx氧化为N2.
分析 (1)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol-1 ②
由盖斯定律②-①得CO(g)+H2O(g)=CO2(g)+H2(g),以此计算△H;
(2)a.随温度升高,平衡向吸热即正反应方向移动,氨气的物质的量逐渐减小;
b.随压强增大,平衡向气体体积减小即逆反应反应移动,氨气的转化率逐渐减小;
c.随反应进行,密闭体积中混合气体的密度自始至终不变;
d.随氨气的物质的量增加,某一生成物的物质的量逐渐增加;
(3)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO;
b.亚硫酸钠不稳定,易被氧气氧化;
c.用CO作脱除剂,则氮氧化物得电子发生还原反应;
d.尿素[CO(NH2)2]中N元素化合价为-3价,具有还原性,在一定条件下能有效将NOx转化为N2.
解答 解:(1)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol-1 ②
由盖斯定律②-①得:
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ•mol-1
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ•mol-1;
(2)a.当X表示温度时,平衡向吸热即正反应方向移动,氨气的物质的量逐渐减小,故a正确;
b.当X表示压强时,平衡向气体体积减小即逆反应反应移动,氨气的转化率逐渐减小,故b正确;
c.当X表示反应时间时,密闭体积中混合气体的密度自始至终不变,故c错误;
d.当x表示氨气的物质的量时,某一生成物的物质的量逐渐增加,故d错误;
故答案为:ab;
(3)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,故a正确;
b.亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,故b正确;
c.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不会生成NO2,烟气中NO2的浓度不增加,故c错误;
d.尿素[CO(NH2)2]中N元素化合价为-3价,具有还原性,在一定条件下能有效将NOx还原为N2,故d错误.
故答案为:ab.
点评 本题考查了反应的焓变判断,热化学方程式的书写,化学平衡的影响因素,氧化还原法除有毒气体等,图象分析是关键,难度中等.

 黄冈创优卷系列答案
黄冈创优卷系列答案| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:
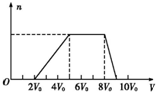
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定不存在的阳离子是Mg2+、Fe3+、Ag+,一定不存在的阴离子是CO32-、AlO2-;含有的阳离子其对应物质的量浓度之比为H+、NH4+、Al3+为2:3:1;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28.0L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | x mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
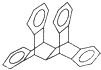 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 该有机物完全燃烧生成CO2和H2O的物质的量之比为15:11 | |
| C. | 该有机物的一氯代物只有4种 | |
| D. | 该有机物既能发生取代反应又能发生加成反应 |