题目内容
5.下列表示物质结构的化学用语正确的是( )| A. | 8个中子的碳原子的核素符号:12C | B. | HF的电子式: | ||
| C. | 氯化镁 | D. | Cl-离子的结构示意图: |
分析 A.质量数=质子数+质子数,C元素的核电荷数=质子数=6,该核素的质量数为14;
B.氟化氢属于共价化合物,其分子式中不存在阴阳离子;
C.氯化镁属于离子化合物,镁离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷;
D.氯离子的核电荷数为17.
解答 解:A.铁元素的核电荷数为6,8个中子的碳原子的质量数为14,该核素符号应该为14C,故A错误;
B.HF是共价化合物,不存在离子键,氟原子与氢原子之间形成1对共用电子对,HF电子式为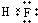 ,故B错误;
,故B错误;
C.氯化镁为离子化合物,阴阳离子需要标出所带电荷,其电子式为: ,故C正确;
,故C正确;
D.氯离子质子数是17,核外电子数是18,有3个电子层,最外层电子数是8,氯离子结构示意图为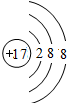 ,故D错误;
,故D错误;
故选C.
点评 考查常用化学用语的表示方法,题目难度中等,注意掌握电子式、离子结构示意图、元素符号化学用语的概念及书写原则,明确离子化合物与共价化合物的电子式的区别,试题培养了学生规范答题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.在只用水和若干试管的条件下,下列各组物质中无法鉴别的是( )
| A. | 硝基苯、苯、乙醇三种液体 | B. | 硫酸钠、硝酸钾、氯化钡三种固体 | ||
| C. | 硫磺、过氧化钠、氯化钙三种固体 | D. | 氯化铝、偏铝酸钠、烧碱三种固体 |
20.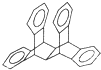 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 该有机物完全燃烧生成CO2和H2O的物质的量之比为15:11 | |
| C. | 该有机物的一氯代物只有4种 | |
| D. | 该有机物既能发生取代反应又能发生加成反应 |
10.下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )
| A. | 10℃20 mL 3mol/L的X溶液 | B. | 20℃30 mL 2molL的X溶液 | ||
| C. | 20℃10 mL 4mol/L的X溶液 | D. | 10℃10 mL 2mol/L的X溶液 |
14.下列各组物质,一定互为同系物的是( )
| A. | 符合同一通式的物质 | |
| B. | 含有相同官能团的物质 | |
| C. | 相对分子质量相差14或者14的倍数的物质 | |
| D. | 通式为CnH2n+2,且C原子数不相等的物质 |
15.在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Νι(ΧΟ)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2.下列说法正确的是( )
| A. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4百分含量将增大 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| C. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| D. | 上述生成Ni(CO)4(g)的反应为吸热反应 |
 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
