题目内容
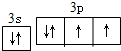
13.下列关于化学用语的表示正确的是( )| A. | 过氧化钠的电子式: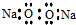 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}Br$ | |
| C. | 硫离子的结构示意图: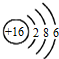 | |
| D. | NH3 的电子式: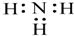 |
分析 A.过氧化钠是离子化合物,其电子式符合离子化合物特点;
B.元素符号的左上角表示的是质量数,左下角表示质子数,质量数=质子数+中子数;
C.硫离子核外有18个电子、最外层有8个电子;
D.氨气中N原子最外层有一孤电子对,据此解答.
解答 解:A.过氧化钠是离子化合物,阴阳离子需要标出所带电荷,过氧化钠正确的电子式为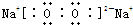 ,故A错误;
,故A错误;
B.元素符号左下角数字表示质子数、左上角数字表示质量数,质子数为35、中子数为45的溴原子的质量数=35+45=80,所以溴原子可以表示为${\;}_{35}^{80}Br$,故B正确;
C.硫离子核外有18个电子、最外层有8个电子,其离子结构示意图为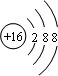 ,故C错误;
,故C错误;
D.NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,故D错误,故选B.
,故D错误,故选B.
点评 本题考查了化学用语的书写判断,涉及核素的表示方法、离子结构示意图、电子式等知识点,题目难度中等,根据这些化学用语特点来分析解答,注意过氧化钠电子式的书写,为易错点.

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
3.组成C11H16为的芳香烃,其苯环上有两个取代基的同分异构体数目为( )
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
8.下列变化过程和对应的能量转化关系错误的是( )
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
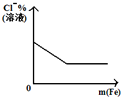
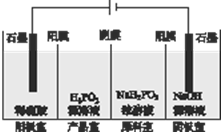 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题: