题目内容
3.以下四种有机物的分子式皆为C4H10O:①
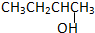 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③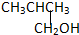 ④
④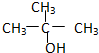
其中能氧化成醛的是( )
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
分析 由醇氧化为醛时,醇应为R-CH2OH,若与-OH相连的C上只有1个H被氧化为酮,若与-OH相连的C上不含H,不能发生催化氧化,以此来解答.
解答 解:醇发生催化氧化的规律是:
当连接羟基的碳上有两个氢原子时,催化氧化成醛;
当连接羟基的碳上有一个氢原子时,催化氧化成酮;
当连接羟基的碳上没有氢原子时,不能催化氧化;
根据以上规律对题中四种有机物进行判断.由结构简式可知,②③均符合R-CH2OH,可氧化为醛,而①氧化为酮,④不能被氧化,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇性质的考查,注意醇催化氧化结构上的特点,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
11.25℃时,水中存在电离平衡:H2O?H++OH-,下列关于水的说法正确的是( )
| A. | 水的电离是吸热过程,升高温度不利于电离 | |
| B. | 向水中加入少量稀硫酸,水的离子积KW不变 | |
| C. | 含H+的溶液显酸性,含OH-的溶液显碱性 | |
| D. | 向水中加入少量氢氧化钠溶液,水的电离程度变大 |
8.某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管、胶头滴管.
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容):
(4)实验结论:同一主族,自上而下,元素的非金属性依次减弱.
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯强:F2在冷暗处就可以与H2剧烈反应而爆炸,而Cl2与H2要在光照或点燃时才反应、HF比HCl更稳定.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管、胶头滴管.
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容):
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫色 |
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯强:F2在冷暗处就可以与H2剧烈反应而爆炸,而Cl2与H2要在光照或点燃时才反应、HF比HCl更稳定.
15.下列有关说法正确的是( )
| A. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| B. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 | |
| C. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀 |
12.下列有关化学用语表示正确的是( )
| A. | 乙炔的结构简式:C2H2 | |
| B. | S2-的结构示意图: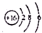 | |
| C. | 甲烷分子的球棍模型 | |
| D. | 硫酸钠的电离方程式:Na2S04=2Na++S042- |
13.下列实验设计或操作正确的是( )
| A. | 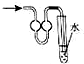 少量氨气的尾气吸收装置 | B. | 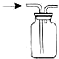 排空气法收集NO气体 | ||
| C. | 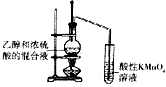 验证乙烯的生成 | D. | 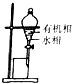 有机相从分液漏斗下口放出 |
 +H2
+H2