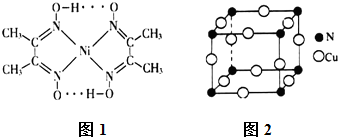
题目内容
17.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 28g乙烯的气体中含有H原子数为2NA | |
| B. | 标准状况下,2.24L乙醇与足量Na反应生成H2分子数0.05NA | |
| C. | 每摩尔-OH中含电子数目为9NA | |
| D. | 每摩尔苯中含有的碳碳双键的数目为3NA |
分析 A.乙烯分子中含有4个H原子,28g乙烯的物质的量为1mol,含有4molH原子;
B.标准状况下,乙醇的状态不是气体;
C.羟基中含有9个电子,1mol羟基中含有9mol电子;
D.苯分子中的碳碳键为一种独特键,不存在碳碳双键.
解答 解:A.28g乙烯的物质的量为:$\frac{28g}{28g/mol}$=1mol,1mol乙烯分子中含有4molH原子,含有H原子数为4NA,故A错误;
B.标况下乙醇不是气体,不能使用标况下的气体摩尔体积计算,故B错误;
C.1mol羟基中含有9mol电子,1mol-OH中含电子数目为9NA,故C正确;
D.苯分子中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算和判断,题目难度中等,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间关系,明确标况下气体摩尔体积的使用条件,C注意羟基与氢氧根离子的区别.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
8.某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管、胶头滴管.
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容):
(4)实验结论:同一主族,自上而下,元素的非金属性依次减弱.
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯强:F2在冷暗处就可以与H2剧烈反应而爆炸,而Cl2与H2要在光照或点燃时才反应、HF比HCl更稳定.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管、胶头滴管.
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容):
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫色 |
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯强:F2在冷暗处就可以与H2剧烈反应而爆炸,而Cl2与H2要在光照或点燃时才反应、HF比HCl更稳定.
5.下列行为中,可行的是( )
| A. | 进入煤矿井时,用火把照明 | |
| B. | 用点燃的火柴在液化气钢瓶旁检验钢瓶是否漏气 | |
| C. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| D. | 某地化工厂的贮藏罐肆意外发生泄漏,有关方面紧急组织群众沿逆风方向疏散 |
12.下列有关化学用语表示正确的是( )
| A. | 乙炔的结构简式:C2H2 | |
| B. | S2-的结构示意图: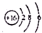 | |
| C. | 甲烷分子的球棍模型 | |
| D. | 硫酸钠的电离方程式:Na2S04=2Na++S042- |
2.下图是铜锌原电池装置.下列有关该装置的说法正确的是( )
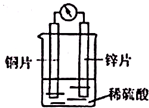

| A. | 溶液中H+向锌极移动 | |
| B. | 铜片是正极,发生氧化反应,有气泡产生 | |
| C. | 锌片上的电极反应式:Zn-2e-═Zn2+ | |
| D. | 电子由铜片经导线流向锌片 |
9.一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志是( )
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | 单位时间里每增加1molN2,同时减少2mol NH3 | |
| D. | 单位时间里每增加1molN2,同时增加3molH2 |
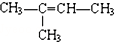
 .
.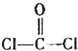 的空间结构为平面三角形.
的空间结构为平面三角形.