题目内容
1.Ca(OH)2溶解度随温度变化曲线如图,下列说法错误的是( )
| A. | a点溶液升高温度后会出现浑浊 | |
| B. | 30℃时Ca(OH)2溶液的浓度一定大于60℃时的浓度 | |
| C. | 30℃时Ca(OH)2的Ksp约等于3.2×10-5 | |
| D. | 若在a点溶液中加入CaO溶液中溶质质量将减少 |
分析 A.根据氢氧化钙的溶解度曲线图可知,氢氧化钙的溶解度随温度的升高而减小,当温度升高时溶液中的溶质就会结晶析出;
B.30℃时Ca(OH)2溶液与60℃Ca(OH)2溶液,不一定都是饱和溶液;
C.根据氢氧化钙的溶解度以及Ca(OH)2固体溶于水后,存在的平衡状态:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)计算;
D.在a点溶液中加入CaO溶液中CaO+H2O═Ca(OH)2,该反应为放热反应.
解答 解:A.由于氢氧化钙的溶解度随温度的升高而减小,因此温度升高时,氢氧化钙的饱和溶液中有一部分溶质就会结晶析出,因此溶液中会出现浑浊,故A正确;
B.氢氧化钙的溶解度随温度的升高而减小,所以是30℃时Ca(OH)2饱和溶液的浓度一定大于60℃时饱和溶液的浓度,但是30℃的Ca(OH)2不饱和溶液的浓度不一定大于 60℃的Ca(OH)2饱和溶液的浓度,故B错误;
C.根据氢氧化钙的溶解度曲线图可知,30℃时Ca(OH)2溶液溶解度为0.15g,氢氧化钙的物质的量为:0.00202mol,100g水体积约为0.1L,氢氧根离子浓度约为2×0.0202mol/L,根据Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),Ksp=C(Ca2+)×C2(OH-)≈3.2×10-5,故C正确;
D.加入少量的氧化钙,氧化钙和氢氧化钙溶液中的水反应CaO+H2O═Ca(OH)2,生成氢氧化钙,所以原氢氧化钙溶液中的溶剂水减少,溶质析出,溶质质量将减少,该反应为放热反应,温度升高,溶解度减小,溶质质量也将减少,故D正确;
故选B.
点评 本题主要考查了固体的溶解度和温度间的关系,掌握氢氧化钙的溶解度随温度的升高而减小是解答关键,尸体培养学生的分析能力和解决问题的能力,题目难度不大.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 水的电离是吸热过程,升高温度不利于电离 | |
| B. | 向水中加入少量稀硫酸,水的离子积KW不变 | |
| C. | 含H+的溶液显酸性,含OH-的溶液显碱性 | |
| D. | 向水中加入少量氢氧化钠溶液,水的电离程度变大 |
| A. | 乙炔的结构简式:C2H2 | |
| B. | S2-的结构示意图: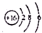 | |
| C. | 甲烷分子的球棍模型 | |
| D. | 硫酸钠的电离方程式:Na2S04=2Na++S042- |
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | 单位时间里每增加1molN2,同时减少2mol NH3 | |
| D. | 单位时间里每增加1molN2,同时增加3molH2 |
| A. | 升高温度 | B. | 分离出HI | C. | 充入H2 | D. | 充入He |
| A. | 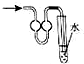 少量氨气的尾气吸收装置 | B. | 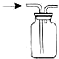 排空气法收集NO气体 | ||
| C. | 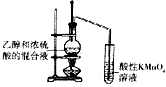 验证乙烯的生成 | D. | 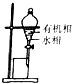 有机相从分液漏斗下口放出 |
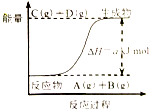
| A. | 若此反应过程中有电子转移,可设计成原电池 | |
| B. | 当A、B、C、D的浓度相同时,反应处于平衡状态 | |
| C. | 当A的消耗速率与C的消耗速率相同时处于平衡状态 | |
| D. | 该反应只有在加热条件下才能进行 |

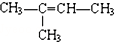
 .
.