题目内容
6.书写电子式或用电子式回答下列问题:①NaOH
 ②H20
②H20 ③O=C=O
③O=C=O ④CCl4
④CCl4 ⑤Fe2+Fe2+⑥N2
⑤Fe2+Fe2+⑥N2
⑦以氟化氢为例表示共价键形成过程
 .
.
分析 先判断化合物类型及所含化学键类型,离子化合物由阳离子与银离子构成,阳离子电子式为阳离子符合,阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构,据此解答.
解答 解:①NaOH为离子化合物,电子式为
故答案为:
②水分子为共价化合物,氧原子分别与两个氢原子通过电子对共用形成共价键,电子式为:
故答案为:
③O=C=O为共价化合物,碳原子与两个氧原子分别共用两对电子,电子式为: ;
;
故答案为: ;
;
④四氯化碳为共价化合物,碳原子与四个氯原子分别共用1对电子,电子式;
故答案为:
⑤金属阳离子电子式为阳离子符号,所以二价铁离子电子式为:Fe2+;
故答案为:Fe2+;
⑥氮气为非金属单质,含有氮氮共价键,两个氮原子之间共用3对电子,电子式 ;
;
故答案为: ;
;
⑦HF为共价化合物,各原子满足8电子稳定结构,共价键形成过程为
故答案为:
点评 本题考查了电子式的书写,明确物质所含化学键的类型及电子式书写应注意的问题是解题关键,注意金属阳离子电子式为其离子符号.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是( )
| A. | 石墨不如金刚石稳定 | |
| B. | 金刚石和石墨互为同位素 | |
| C. | 石墨能量高于金刚石 | |
| D. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量少 |
17.下列关于物质性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 碱性强弱:KOH>Ca(0H)2>Mg(OH)2 | D. | 还原性强弱:I一>CI一>F? |
14.在A、B、C三支试管中分别加入等体积0.1 mol/L Fe2(SO4)3溶液.将A试管在酒精灯火焰上加热到沸腾,向B试管中加3滴6 mol/L H2SO4.下列说法不正确的是( )
| A. | 最终三支试管的颜色各不相同 | |
| B. | A试管中Fe(OH)3含量最高 | |
| C. | 直接加热蒸发Fe2(SO4)3溶液可得到Fe2(SO4)3晶体 | |
| D. | B试管中Fe2(SO4)3不能发生水解 |
4.化学与人类生活、生成和社会可持续发展密切相关,下列说法正确的是( )
| A. | 铜矿石在细菌作用下直接转换为单质铜,这个过程中叫做生物炼铜 | |
| B. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,相同条件下,某物质的热值越高,其标准燃烧越大 | |
| C. | 铅蓄电池是最常见的二次电池,可根据硫酸的密度来判断铅蓄电池是否需要充电 | |
| D. | “地沟油”禁止食用,但可以通过物理变化制肥皂 |
11.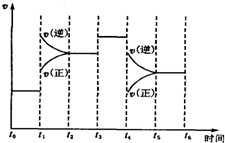 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
(1)该反应的化学平衡常数K与温度T的关系如下
其中K1> K2 (填“>”“<”或“=”)
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.(1)该反应的化学平衡常数K与温度T的关系如下
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
8.下列实验装置设计不恰当的是( )
| A. |  钾的燃烧实验 | B. |  用强碱滴定强酸 | ||
| C. |  铁与H2O(g)反应 | D. |  探究温度对平衡移动的影响 |
9.如图是元素周期表中关于碘元素的信息,其中解读正确的是( )


| A. | 碘元素的质子数为53 | |
| B. | 碘原子的质量数为126.9 | |
| C. | 碘原子核外有5种不同能量的电子 | |
| D. | 碘原子最外层有7种不同运动状态的电子 |

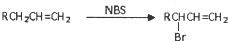
 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式 (其中之一).
(其中之一).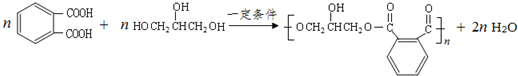 .
.