题目内容
9.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为碳元素;W与X同主族,所以W是Si元素;Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,离子核外电子数为10,故Z的质子数为12,则Z为Mg,据此解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为碳元素;W与X同主族,所以W是Si元素;Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,离子核外电子数为10,故Z的质子数为12,则Z为Mg.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:r(Mg)>r(Si)>r(C)>r(O),故A错误;
B.Y和Z、W形成的化合物为MgO、SiO2,MgO、SiO2中存在的化学键分别是离子键、共价键,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性X(C)>W(Si),所以X的最高价氧化物对应水化物的酸性比W的强,故C正确;
D.元素的非金属性越强,其气态氢化物的稳定性越强,非金属性Y(O)>W(Si),所以Y的气态简单氢化物的热稳定性比W的强,故D正确;
故选CD.
点评 本题考查原子结构和元素周期律,明确物质结构、元素周期律即可解答,熟练掌握同一周期、同一主族元素性质递变规律,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
17.下列关于物质性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 碱性强弱:KOH>Ca(0H)2>Mg(OH)2 | D. | 还原性强弱:I一>CI一>F? |
4.下列关于有机物的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | C4H10有三种同分异构体 | |
| C. | 氨基酸、淀粉均属于高分子化合物 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
14.在A、B、C三支试管中分别加入等体积0.1 mol/L Fe2(SO4)3溶液.将A试管在酒精灯火焰上加热到沸腾,向B试管中加3滴6 mol/L H2SO4.下列说法不正确的是( )
| A. | 最终三支试管的颜色各不相同 | |
| B. | A试管中Fe(OH)3含量最高 | |
| C. | 直接加热蒸发Fe2(SO4)3溶液可得到Fe2(SO4)3晶体 | |
| D. | B试管中Fe2(SO4)3不能发生水解 |
11. 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
(1)该反应的化学平衡常数K与温度T的关系如下
其中K1> K2 (填“>”“<”或“=”)
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
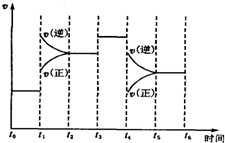
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.(1)该反应的化学平衡常数K与温度T的关系如下
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
12. 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )| A. | 分子中不含有非极性键 | B. | 1mol该分子中含8mol二氧化氮 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、C02、H20 |
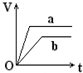
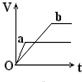
 向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液.下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液.下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )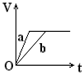

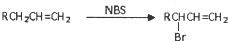
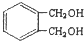 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式 (其中之一).
(其中之一). .
.