题目内容
1.化学中常用图象直观地描述化学反应的进程或结果.只改变一个条件,则下列对图象的解读正确的是( )| A. | 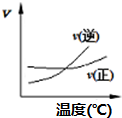 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 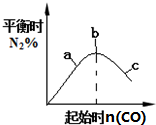 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. |  N2(g)+3H2(g)?2NH3(g)如图说明t秒时合成氨反应达到平衡 | |
| D. |  2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |
分析 A、根据图①可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动,据此判断;
B、增加一种反应物的量会增大另一种反应物的转化率;
C、根据正逆反应速率相等来判断化学平衡状态;
D、根据图示可以看出压强只能改变反应速率但是不改变平衡的移动.
解答 解:A、根据图①可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动,升高温度平衡向吸热反应移动,故可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应,故A错误;
B、根据反应原理方程式,增加一种反应物NO的量会增大另一种反应物二氧化氮的转化率,所以c点的转化率大于a点,故B错误;
C、2v(N2)正=v(NH3)逆时,正逆反应速率相等,此时化学反应达到了平衡状态,故C错误;
D、根据图示可以看出压强只能改变反应速率但是不改变平衡的移动,所以反应是前后气体的系数和相等的反应,即D一定是气体,故D正确.
故选D.
点评 本题涉及化学平衡移动原理的应用、化学平衡的判断、以及反应的热量变化等知识,难度不大.

练习册系列答案
相关题目
11. 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
(1)该反应的化学平衡常数K与温度T的关系如下
其中K1> K2 (填“>”“<”或“=”)
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
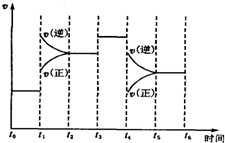
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.(1)该反应的化学平衡常数K与温度T的关系如下
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
12. 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )| A. | 分子中不含有非极性键 | B. | 1mol该分子中含8mol二氧化氮 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、C02、H20 |
9.如图是元素周期表中关于碘元素的信息,其中解读正确的是( )


| A. | 碘元素的质子数为53 | |
| B. | 碘原子的质量数为126.9 | |
| C. | 碘原子核外有5种不同能量的电子 | |
| D. | 碘原子最外层有7种不同运动状态的电子 |
16.工业上以CaO和HNO3为原料制备Ca(NO3)2•6H2O晶体.为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为( )
| A. | 53.8% | B. | 58.3% | C. | 60.3% | D. | 70.0% |
6.常温下,运用电离理论做出的预测正确的是( )
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
13.化学已渗透到人类生活的各个方面.下列说法正确的是( )
| A. | 为防止富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 铬是人体必需的微量元素,但铬过量会危害人体健康,其中六价铬的毒性最大.人体内六价铬超标,可以服用维生素C缓解毒性,说明维生素C具有氧化性 | |
| C. | 去年冬天的雾霾天气严重影响了人们的正常出行和生活节奏.为改善空气质量,可以加高工厂的烟囱,使烟尘和废气远离地表 | |
| D. | 硅酸钠是最简单的硅酸盐,是制备硅胶和木材防火剂的原料 |
10.硼烷是一种潜在的高能燃料,工业制取可用反应:B2O3+2Al+3H2=Al2O3+B2H6,下列有关说法正确的是( )
| A. | 该反应中氢气做还原剂,铝做氧化剂 | |
| B. | 在空气中Al2O3比 B2H6更稳定 | |
| C. | B2H6中存在极性键、非极性键、离子键 | |
| D. | 每生成1mol B2H6要消耗2molAlCl3 |
11.下列说法正确的是( )
| A. | 科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用SMT技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 | |
| B. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 | |
| C. | 今年,来自德国、加拿大和我国复旦、清华大学的研究人员通过紧密合作,成功制备出了含+9铱元素的离子(IrOn+).在这种离子中,n=8 | |
| D. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |