题目内容
1.在体积不变的容器中发生反应:2HI(g)?H2(g)+I2(g),下列叙述中可以说明反应已达平衡状态的是( )①一个H-H键断裂的同时有两个H-I键断裂;②HI浓度等于I2浓度;③反应速率v正(H2)=v逆(HI);④HI、H2、I2分子数之比为2:1:1;⑤容器内压强不变;⑥容器内气体颜色不再变化.
| A. | ①③⑤ | B. | ②⑥ | C. | ④⑤ | D. | ①⑥ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,故正确;
②百分含量C(HI)=C(I2),相等并不是不变,故错误;
③反应速率v正(H2)=v逆(HI),而速率之比与计量数不成比例,故错误;
④N(HI):N(H2):N(I2)=2:1:1),相等并不是不变,故错误;
⑤温度和体积一定时,容器内压强不再变化,容器压强始终不变,故错误;
⑥容器内气体颜色不再变化,说明碘的浓度不变,正逆反应速率相等,故正确;所以①⑥正确;
故选:D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
16.下列叙述正确的是( )
| A. | H2 和D2 互为同位素 | |
| B. | 40Ca和40K中质子数和中子数都不相等 | |
| C. | 只含一种元素的物质一定是纯净物 | |
| D. | 18O中中子数和质子数相等 |
13.某些元素可用于制造半导体材料,它们在周期表中分布于( )
| A. | 第18列 | B. | 左下方区域 | ||
| C. | 右上方区域 | D. | 金属和非金属元素分界线附近 |
10.下列实验操作方法正确的是( )
| A. | 在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡,再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基 | |
| B. | 将无水乙醇加热至170℃时,可以制得乙烯 | |
| C. | 用氢氧化钠溶液清洗盛过苯酚的试管 | |
| D. | 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素 |

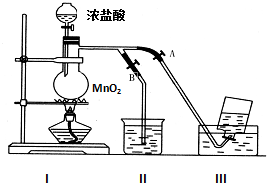 如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.